题目内容
4.在某100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4mol•L-1、0.1mol•L-1,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol•L-1)是( )| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
分析 n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,判断过量后以不足量代入计算.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,
由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,Cu与NO3-过量,H+不足,
n(Cu2+)=0.06mol×$\frac{3}{8}$=0.0225mol,
所得溶液中铜离子物质的量浓度为$\frac{0.0225mol}{0.1L}$=0.225mol/L,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意过量计算的判断,题目难度不大.

练习册系列答案
相关题目
14.将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应.有关叙述正确的是( )
| A. | 固体分解越完全,消耗盐酸的量越少 | |
| B. | 共生成0.1mol二氧化碳,固体中氯化钠为5.85g | |
| C. | 固体中碳酸氢钠含量越多,钠元素的含量也越多 | |
| D. | 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g |
15.下列有关物质的性质与用途具有对应关系的是( )
| 性质 | 用途 | |
| A | 液氨气化吸热 | 可用作制冷剂 |
| B | NH4HCO3受热易分解 | 可用作氮肥 |
| C | 二氧化硅能与HF反应 | 可用作光导纤维 |
| D | 二氧化硫能使溴水褪色 | 可用作漂白剂 |
| A. | A | B. | B | C. | C | D. | D |
12.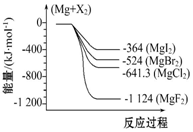 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
19.下列离子方程式正确的是( )
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
9. 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质.
①写出该反应的化学反应方程式:4NH3+6NO=5N2+6H2O.
②已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.105℃时,则上述脱硝反应的△H=-1811.63kJ•mol-1,该反应能(填“能”“否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为3:2.每生成1mol还原产物,则反应中转移电子数为4mol.
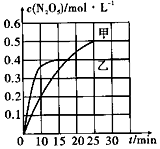
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)?N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
①0~10min内甲容器中反应的平均速率:v(O3)=mol•L-1•min-1.
②T1<T2(填“>”“<”或“=”),T1时,该反应的平衡常数为0.5L•mol-1.
③下列措施能提高容器乙中NO2转化率的是D (填序号).
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,
v(正)<v(逆) (填“>”“<”“=”).
 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质.
①写出该反应的化学反应方程式:4NH3+6NO=5N2+6H2O.
②已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.105℃时,则上述脱硝反应的△H=-1811.63kJ•mol-1,该反应能(填“能”“否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为3:2.每生成1mol还原产物,则反应中转移电子数为4mol.
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)?N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
②T1<T2(填“>”“<”或“=”),T1时,该反应的平衡常数为0.5L•mol-1.
③下列措施能提高容器乙中NO2转化率的是D (填序号).
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,
v(正)<v(逆) (填“>”“<”“=”).
16.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述中正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物对应水化物的碱性A<C | |
| B. | 氢化物的稳定性H2D<H2E | |
| C. | 单质与稀盐酸反应的速率A<B | |
| D. | C2+与A+的核外电子数相等 |
13.下列物质中含有少量杂质,能用饱和碳酸钠溶液并借助于分液漏斗除去杂质的是( )
| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
15.某校化学实验兴趣小组在“探究物质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含Br2(填化学式或离子符号,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中.(试剂填序号)
(4)应用与拓展
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含Br2(填化学式或离子符号,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.