题目内容
11.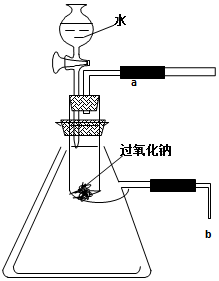 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.(1)由上述实验现象可得出两条有关过氧化钠跟水反应的结论是:
第一:有氧气放出;
第二:有热量放出.
(2)某研究性学习小组拟用如图所示的装置进行实验,以验证上述结论.
用以验证第一条结论的实验操作是打开活塞(或阀门)向试管内包有过氧化钠的石棉网上滴几滴水,用带火星的木条靠近a处现象是带火星的木条复燃.
为了验证第二条结论,将管口b浸入水中,可观察到的现象为
发现b处有气泡放出.
(3)将等物质的量的过氧化钠和硫酸亚铁投入水中完全反应产生
的化学方程式为:4FeSO4+4Na2O2+6H2O=4Fe(OH)3↓+4Na2SO4+O2↑.
分析 (1)燃烧的条件是①物质具有可燃性,②可燃物与氧气接触,③温度达到可燃物的着火点,根据燃料燃烧的条件分析;
(2)氧气具有能使带火星的木条复燃的性质;气体具有热胀冷缩的性质,该反应放出的热量能使集气瓶内空气的压强增大,据此分析问题;
(3)过氧化钠具有强氧化性,等物质的量的过氧化钠和硫酸亚铁投入水中完全反应生成氢氧化铁和氧气,据此书写方程式.
解答 解:( 1)脱脂棉剧烈燃烧说明具备燃烧的条件,试管内空气较少,若剧烈燃烧应该有大量氧气,只有该反应是放热反应才能使燃料温度达到着火点,根据题意知该反应有氧气生成且放热,故答案为:有氧气放出;有热量放出;
(2)氧气具有使带火星的木条复燃的性质,所以可用带火星的木条靠近a处,如果木条复燃,则有氧气生成,反之无氧气生成;气体具有热胀冷缩的性质,如果该反应放热,放出的热量能使集气瓶内空气的压强增大;如果b导管插入盛水的小烧杯中,有气泡冒出,证明此反应放热;
故答案为:打开活塞(或阀门)向试管内包有过氧化钠的石棉网上滴几滴水,用带火星的木条靠近a处;带火星的木条复燃;发现b处有气泡放出;
(3)过氧化钠具有强氧化性,等物质的量的过氧化钠和硫酸亚铁投入水中完全反应生成氢氧化铁和氧气,则发生的方程式为:4FeSO4+4Na2O2+6H2O=4Fe(OH)3↓+4Na2SO4+O2↑,故答案为:4FeSO4+4Na2O2+6H2O=4Fe(OH)3↓+4Na2SO4+O2↑.
点评 本题考查了过氧化钠和水反应的实验,难度不大,解答时要从实验现象方面进行分析、判断,从而得出正确的结论,难度不大.

练习册系列答案
相关题目
1.m g Fe2O3、CuO的混合物,加入60mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液20mL;将m g的混合物用CO气体加热还原,实验过程中总共耗去标准状况下的CO 1.68升,得固体w g,w的值为( )
| A. | m-0.48 | B. | m-0.72 | C. | m-0.8 | D. | m-1.2 |
19.下列离子方程式正确的是( )
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
6.下列溶液中能大量共存的离子组是( )
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
16.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述中正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物对应水化物的碱性A<C | |
| B. | 氢化物的稳定性H2D<H2E | |
| C. | 单质与稀盐酸反应的速率A<B | |
| D. | C2+与A+的核外电子数相等 |
3.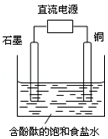 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜是电解池的阳极 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上产生的是无色气体 | D. | 石墨电极上发生还原反应 |