题目内容
14.用 NA表示阿伏加德罗常数的值.下列判断正确的是( )| A. | 44g CO2含有的原子数目为 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100mL12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18mL 水含有的分子数目约为 NA |
分析 A、求出二氧化碳的物质的量,然后根据二氧化碳中含3个原子来分析;
B、铵根离子为弱碱阳离子,在溶液中会水解;
C、二氧化锰只能与浓盐酸反应,和稀盐酸不反应;
D、求出水的质量和物质的量,根据分子个数N=nNA来分析.
解答 解:A、44g二氧化碳的物质的量为1mol,而二氧化碳中含3个原子,故1mol二氧化碳中含3NA个原子,故A错误;
B、铵根离子为弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于2NA个,故B错误;
C、二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故浓盐酸不能反应完全,则转移的电子数小于0.6NA个,故C错误;
D、常温常压下,水的密度为1g/mL,故18mL水的质量为18g,物质的量为1mol,故分子个数N=nNA=NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构

练习册系列答案
相关题目
4.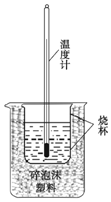 实验室利用如图装置进行中和热的测定. 回答下列问题:
实验室利用如图装置进行中和热的测定. 回答下列问题:
(1)该图中有两处未画出,它们是环形玻璃搅拌棒和烧杯上方盖硬纸板.
(2)把温度为13℃,浓度为1.0mol•L-1的盐酸和1.1mol•L-1的碱溶液 各 50mL混合,轻轻搅动,测得酸碱混合液的温度变化数据如表:
则a>b(填“>”“<”“=”);实验中碱液过量的目的是使盐酸充分反应,提高实验的准确度.已知:稀溶液的密度近似为1g/mL,其比热容约为4.18J/(g•℃),则a=56.8.
 实验室利用如图装置进行中和热的测定. 回答下列问题:
实验室利用如图装置进行中和热的测定. 回答下列问题:(1)该图中有两处未画出,它们是环形玻璃搅拌棒和烧杯上方盖硬纸板.
(2)把温度为13℃,浓度为1.0mol•L-1的盐酸和1.1mol•L-1的碱溶液 各 50mL混合,轻轻搅动,测得酸碱混合液的温度变化数据如表:
| 反应物 | 起始温度(℃) | 终了温度(℃) | 中和热(kJ•mol-1) |
| ①HCl+NaOH | 13 | 19.8 | -a |
| ②HCl+NH3•H2O | 13 | 19.3 | -b |
5.下列各组物质中,所含化学键类型相同,融化时克服的作用力也相同的是( )
| A. | 明矾和金刚石 | B. | 硫磺和人黄铜 | C. | 甲烷和干冰 | D. | 氯化铵和可燃冰 |
9.某地村民饮用井水,但暴雨过后井水混浊,无法饮用.你认为他们应该向井水中最好投入下列中的( )
| A. | FeCl3 | B. | Na2CO3 | C. | KAl(SO4)2•12H2O | D. | CuSO4 |
19.下列离子方程式正确的是( )
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
6.下列溶液中能大量共存的离子组是( )
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
3.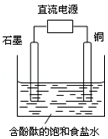 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜是电解池的阳极 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上产生的是无色气体 | D. | 石墨电极上发生还原反应 |