题目内容
5.(1)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为1s22s22p63s23p4;其最高价氧化物对应水化物的化学式是H2SO4.(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其中NF3的分子空间构型为三角锥形,中心原子的杂化方式为:sp3杂化BF3的分子空间构型为平面正三角形.
(3)现有下列物质:①金刚石②干冰③氯化铵④氖⑤金属锌⑥石英⑦硫化氢通过非极性键形成原子晶体的是①;属于分子晶体②;含有极性键的离子化合物是④.(均填序号).
分析 (1)根据激发态原子核外电子排布式确定该原子核外电子数,原子中核外电子数=原子序数,从而确定该元素,根据构造原理写出该元素基态原子核外电子排布式,在主族元素中,元素的最高化合价等于其族序数,从而确定其最高价氧化物对应的水化物;
(2)N元素的氟化物中氮原子含有孤电子对,B元素的氟化物中B元素不含孤电子对,导致其空间构型不同;根据价层电子对互斥理论确定BF3的分子空间构型;
(3)①金刚石为原子晶体,含有非极性键;
②干冰属于分子晶体、是直线型分子;
④氖是由单原子分子构成的分子晶体;
③氯化铵为离子化合物,含有极性键;
⑤金属锌是能导电的金属晶体;
⑥石英为原子晶体,含有极性键;
⑦硫化氢属于分子晶体、是V型分子.
解答 解:(1)根据激发态原子核外电子排布式知该元素核外有16个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p4,原子序数=原子核外电子数,所以该元素是S元素,S元素最外层有6个电子,其最高化合价是+6价,其最高价氧化物对应的水化物是硫酸,其化学式为H2SO4,
故答案为:1s22s22p63s23p4;H2SO4;
(2)N元素的氟化物中氮原子含有孤电子对,B元素的氟化物中B元素不含孤电子对,NF3中N原子含有3个σ键和1个孤电子对,所以NF3为三角锥构型,中心原子周围三个σ键和一对孤对电子对,所以是sp3杂化;BF3中B原子含有3个σ键且不含孤电子对,所以BF3为平面三角形构型,故答案为:三角锥形;sp3杂化;平面正三角形;
故答案为:三角锥形;平面三角形;
(3)①金刚石为原子晶体,含有非极性键;
②干冰属于分子晶体、是直线型分子;
④氖是由单原子分子构成的分子晶体;
③氯化铵为离子化合物,含有极性键;
⑤金属锌是能导电的金属晶体;
⑥石英为原子晶体,含有极性键;
⑦硫化氢属于分子晶体、是V型分子.
故答案为:①;②;④.
点评 本题考查晶体类型、空间构型、键的极性等知识,难度不大.要注意基础知识的积累.

 名校课堂系列答案
名校课堂系列答案| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
| A. | 在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是4 一5 min,因为在此段时间内反应放出的热量较多 | |
| B. | 在2一3min时间段内,用盐酸的浓度变化表示的反应速率为0.lmol/(L•min) | |
| C. | 在该稀盐酸中分别加入等体积的蒸馏水、Na2SO4溶液或Na2CO3溶液都能减缓反应速率且不减少产生氢气的量 | |
| D. | 为了加快该化学反应速率,可以向其中加入NaCl固体 |
| A. | 实验室可用蒸馏法提纯工业乙醇 | |
| B. | 葡萄糖用于制镜业是利用了葡萄糖的还原性 | |
| C. | 1mol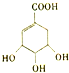 最多可与4 mol NaOH 发生反应 最多可与4 mol NaOH 发生反应 | |
| D. | 1-氯丙烷和2-氯丙烷分别与NaOH 乙醇溶液共热,都可得到丙烯 |

| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 总反应式为2H2+O2=2H2O | |
| D. | 导电离子为质子,且在电池内部由正极定向移向负极 |
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H三种核素的性质不同 | |
| B. | 16O2、18O2彼此是同位素 | |
| C. | 14N、14C两种核素的中子数相同,质子数不同 | |
| D. | 白磷与红磷是磷元素的两种同素异形体 |
| A. | 含离子键的化合物是离子化合物,含共价键的化合物是共价化合物 | |
| B. | 离子键的形成过程中一定有电子得失 | |
| C. | 第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键 | |
| D. | 离子键与共价键的本质都是静电作用 |