题目内容
17.下列说法正确的是( )| A. | 含离子键的化合物是离子化合物,含共价键的化合物是共价化合物 | |
| B. | 离子键的形成过程中一定有电子得失 | |
| C. | 第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键 | |
| D. | 离子键与共价键的本质都是静电作用 |
分析 A.含共价键的不一定为共价化合物;
B.离子键形成不一定发生化学变化;
C.H位于第IA族,与第ⅥA、ⅦA族元素可形成共价键;
D.离子键与共价键均为化学键.
解答 解:A.含共价键的不一定为共价化合物,如NaOH为离子化合物中含共价键,故A错误;
B.离子键形成不一定发生化学变化,如NaCl溶液蒸发得到NaCl,故B错误;
C.H位于第IA族,与第ⅥA、ⅦA族元素可形成共价键,碱金属、碱土金属与ⅥA、ⅦA族元素一定形成离子键,故C错误;
D.离子键与共价键均为化学键,本质都是静电作用,故D正确;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断、常见物质中的化学键为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.水的电离平衡曲线如图所示,下列说法中正确的是( )
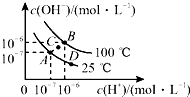

| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 若处在B点,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性 | |
| C. | 25℃时,保持温度不变,在水中加入适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42- |
8.下列分子种的碳原子不可能同在一个平面的是( )
| A. |  | B. |  | C. |  | D. |  |
2.被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在另一边镀二氧化锰.在纸内是离子“流过”水和氧化锌组成的电解液.电池总反应Zn+2MnO2+H2O=ZnO+2MnO(OH),下列说法正确的是( )
| A. | 该电池的电流方向是由锌到二氧化猛 | |
| B. | 该电池反应中MnO2起催化作用 | |
| C. | 当0.1molZn完全溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 电池正极反应为2MnO2+e-+2H2O=2MnO(OH)+2OH- |
 .
.