题目内容
16.已知:实验室制乙烯的装置如图: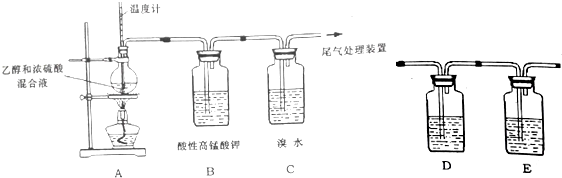
实验步骤如下:
a.如图连接好装置,检验气密性
b.添加药品,点燃酒精灯
c.观察实验现象:高锰酸钾溶液和溴水颜色逐渐褪去,烧瓶内液体渐渐变黑,能闻到刺激性气味
d.…
(1)写出实验室制取乙烯的化学反应方程式:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)分析:甲认为使二者褪色的是乙烯,乙认为有副反应,不能排除另一种酸性气体的作用.
①根据甲的观点,写出乙烯使酸性高锰酸钾溶液褪色的离子反应方程式:5CH2=CH2+12MnO4-+36H+=12Mn2++10CO2↑+28H2O;
②为进一步验证使酸性高锰酸钾溶液褪色的是乙烯,在A、B间增加下列 装有某种试剂的洗气瓶:
D中盛装的试剂是a,E中盛装的试剂是c;(填序号)
a.NaOH溶液 b.稀硫酸溶液
c.品红试液 d.溴的四氯化碳溶液
(3)乙烯使溴水褪色,丙同学认为是加成反应,丁同学认为是取代反应,请 设计一个简单实验验证哪个同学正确:测定反应前后溴水的PH值,若PH值变大,则为加成反应,若PH值变小则为取代反应
(4)H2SO4在这个反应中做催化剂,有种观点认为其催化过程可分三步简单表示如下:
①a.烊盐的生成:CH3CH2OH+H2SO4→CH3CH2O+H2(烊盐)+HSO4-
b.乙基正离子的生成:CH3CH2+H2→CH3CH2++H2O
c.乙烯的生成:CH3CH2++HSO4-→CH2=CH2↑+H2SO4
②关于浓硫酸的催化作用,下列叙述正确的是BC
A.降低了反应的焓变
B.增大了反应的速率
C.降低了反应的活化能
D.增大了反应的平衡常数.
分析 (1)乙醇在浓硫酸作用下加热至170℃,发生消去反应生成乙烯;
(2)①乙烯含有碳碳双键具有强的还原性,被高锰酸钾氧化生成二氧化碳和水;
②制取的乙烯中含有二氧化硫,二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,检验乙烯应排除二氧化硫的干扰;
(3)溴水中存在Br2+H2O?HBr+HBrO,若发生加成反应,则消耗溴单质平衡逆向移动,溶液酸性减弱,若发生取代反应则生成强酸HBr,溶液酸式增强,据此解答;
(4)①依据浓硫酸在反应中起催化剂作用判断解答;
②A.反应焓变与反应物生成物状态有关,与催化剂无关;
B.依据催化剂对反应速率的影响;
C.使用催化剂能够降低反应的活化能;
D.平衡常数只与温度有关.
解答 解:(1)乙醇在浓硫酸作用下加热至170℃,发生消去反应生成乙烯,反应方程式:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)①乙烯含有碳碳双键具有强的还原性,被高锰酸钾氧化生成二氧化碳和水,化学方程式:5CH2=CH2+12MnO4-+36H+=12Mn2++10CO2↑+28H2O;
故答案为:5CH2=CH2+12MnO4-+36H+=12Mn2++10CO2↑+28H2O;
(3)②制取的乙烯中含有二氧化硫,二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,检验乙烯应排除二氧化硫的干扰,二氧化硫为酸性氧化物,能够被氢氧化钠溶液吸收,然后用品红溶液检验二氧化硫是否除尽,再通入酸性的高锰酸钾溶液,所以D中盛装的试剂是氢氧化钠,E中盛装的试剂是品红溶液;
故答案为:a;c;
(3)溴水中存在Br2+H2O?HBr+HBrO,若发生加成反应,则消耗溴单质平衡逆向移动,溶液酸性减弱,若发生取代反应则生成强酸HBr,溶液酸式增强,所以可以测定溴水反应前后后溶液pH变化:若PH值变大,则为加成反应,若PH值变小则为取代反应;
故答案为:测定反应前后溴水的PH值,若PH值变大,则为加成反应,若PH值变小则为取代反应;
(4)①浓硫酸在乙醇消去生成乙烯的反应中起催化剂作用,所以反应后生成产物为乙烯和硫酸,反应方程式:烯的生成:CH3CH2++HSO4-→CH2=CH2↑+H2SO4;
故答案为:CH3CH2+ HSO4- H2SO4;
②A.反应焓变与反应物生成物状态有关,与催化剂无关,所以使用浓硫酸不会改变反应焓变,故A错误;
B.催化剂能够加快反应速率,故B正确;
C.使用催化剂能够降低反应的活化能,使 更多分子变为活化分子,加快反应速率,故C正确;
D.平衡常数只与温度有关,温度不变,平衡常数不变,故D错误;
故选:BC
点评 本题以乙烯的实验室制备和性质检验载体考查了乙醇消去反应,明确反应原理及乙烯的性质是解题关键,注意催化剂对反应速率的影响,注意平衡常数只与温度有关,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案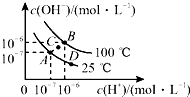
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 若处在B点,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性 | |
| C. | 25℃时,保持温度不变,在水中加入适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42- |
| A. | 核裂变是一种化学变化 | |
| B. | 12753I的质量数为127,原子序数为53,核内有74个中子 | |
| C. | 碘12753I和放射性碘13153I属于同素异形体 | |
| D. | 12753I与13153I是同一种核素 |
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的小(填“大”或“小”);
(3)X 和Y的气态氢化物中,熔沸点较高的是H2O(写化学式).原因:H2O分子间形成氢键
(4)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
 .
. | 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
| A. |  | B. |  | C. |  | D. |  |