题目内容
11.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 9gD2O中含有的电子数为5NA | |
| B. | 1molMgCl2中含有的离子数为2NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA |
分析 A、求出重水的物质的量,然后根据重水中含10个电子来分析;
B、氯化镁中含1个镁离子和2个氯离子;
C、1个甲烷分子中含4条共价键;
D、求出氯气的物质的量,然后根据氯气和氢氧化钠反应时,1mol氯气转移1mol电子来分析.
解答 解:A、9g重水的物质的量为n=$\frac{9g}{20g/mol}$=0.45mol,而重水中含10个电子,故0.45mol重水中含4.5NA个电子,故A错误;
B、氯化镁中含1个镁离子和2个氯离子,故1mol氯化镁中含3NA个离子,故B错误;
C、1个甲烷分子中含4条共价键,故1mol甲烷中含4NA条共价键,故C正确;
D、7.1g氯气的物质的量为0.1mol,而氯气和氢氧化钠反应时,1mol氯气转移1mol电子,故0.1mol氯气转移0.1NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.不足量的锌粉与100mL 0.1mol/L的稀硫酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 ( )
①加KNO3固体
②加NaOH固体
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度
⑧改用10mL 1mol/L硫酸.
①加KNO3固体
②加NaOH固体
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度
⑧改用10mL 1mol/L硫酸.
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ⑥⑦⑧ | D. | ③⑦⑧ |
2.下列说法正确的是( )
| A. | 乙烯、乙醇、过氧化钠、CaCl2都含有非极性键 | |
| B. | 乙醇、乙酸、水分子中均含有氢键 | |
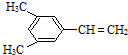
| C. | 甲苯分子中共平面的原子最多有13个 | |
| D. | BF3、PCl3、CCl4、苯中所有原子全部满足最外层为8个电子结构 |
19.人造光卤石(KCl•MgCl2•6H2O)是盐化工的中间产物.以光卤石为原料制得金属镁,可有下列步骤,正确的顺序是( )
①过滤②溶解③加入适量Ca(OH)2④蒸发结晶⑤用盐酸溶解⑥电解熔融MgCl2⑦MgCl2•6H2O脱水.
①过滤②溶解③加入适量Ca(OH)2④蒸发结晶⑤用盐酸溶解⑥电解熔融MgCl2⑦MgCl2•6H2O脱水.
| A. | ⑤③①②④⑥⑦ | B. | ②③①⑤④⑦⑥ | C. | ②④①③⑦⑤⑥ | D. | ⑤③①④②⑦⑥ |
6.300mL0.1mol•L-1Na2SO4溶液与100mL0.2mol•L-1Al2(SO4)3溶液中所含SO42-物质的量之比是( )
| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 3:2 |
4.下列微粒的核外电子排布式书写违反泡利原理的是( )
| A. | C:1s22s22p2 | B. | Na+:1s22s22p43s2 | ||
| C. | S2-:1s22s22p23s23p4 | D. | K:1s22s22p63s23p7 |
8.在氧化还原反应中,水既不作氧化剂又不作还原剂的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | Cl2+H2O═HCl+HClO |
9.下列物质性质变化规律正确的是( )
| A. | O、F、H的原子半径依次减小 | |
| B. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| C. | 干冰、钠、冰的熔点依次降低 | |
| D. | 金属Na、Mg、Al的硬度依次降低 |
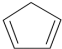 )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线: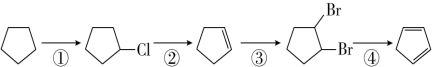
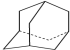 ),途径如下:
),途径如下: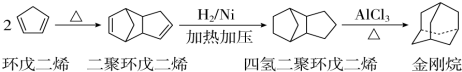
 和
和 .
.