题目内容
1.不足量的锌粉与100mL 0.1mol/L的稀硫酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 ( )①加KNO3固体
②加NaOH固体
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度
⑧改用10mL 1mol/L硫酸.
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ⑥⑦⑧ | D. | ③⑦⑧ |
分析 为了加快此反应速率而不改变H2的产量,少量锌粉完全反应,则可增大氢离子浓度、构成原电池、升高温度等来加快反应速率,以此来解答.
解答 解:①硝酸根离子在酸性条件下具有强氧化性,与锌反应不生成氢气,故错误;
②加NaOH固体,消耗硫酸,氢离子浓度降低,反应速率减小,故错误;
③滴入几滴浓盐酸,氢离子浓度增大,反应速率增大,故正确;
④加CH3COONa固体,生成醋酸,氢离子浓度降低,反应速率减小,故错误;
⑤加NaCl溶液,氢离子浓度降低,反应速率减小,故错误;
⑥滴入几滴硫酸铜溶液,锌置换出铜,生成氢气减少,故错误;
⑦升高温度,反应速率增大,故正确;
⑧改用10mL 1mol/L硫酸,氢离子浓度增大,反应速率增大,故正确.
故选D.
点评 本题考查影响反应速率的因素,明确常见的温度、浓度、原电池对反应速率的影响即可解答,注意锌粉少量完全反应,生成的氢气由锌粉决定为解答的易错点,解答中易多选①,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
11.完全燃烧 20mL由两种气态烃组成的混合物,生成50mL H2O(g)和40mL CO2 (在同温同压下测定).该混合物是( )
| A. | C2H2 C2H4 | B. | CH4 C3H6 | C. | CH4 C4H8 | D. | C2H6 C3H8 |
12.短周期主族元素X、Y、Z、W、R原子序数依次增大,X原子的最外层电子数是次外层的3倍,Y与X可形成离子化合物Y2X和Y2X2,Z所在的周期数等于族序数的位置,W的单质广泛用作半导体材料,R的常见化合价为-1、+1、+4、+5、+7.下列叙述不正确的是( )
| A. | WX2是生产光导纤维的原料 | |
| B. | RX2可用作自来水的消毒剂 | |
| C. | 工业上获得单质Y是用氢气热还原YR得到 | |
| D. | Y、Z、R的最高价氧化物的水化物两两之间均能发生反应 |
9.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )

| A. | 锌是负极,电子流向为“锌片→LED灯→铜片→稀H2SO4→锌片” | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,LED 灯不能发光 | |
| D. | 该电源工作时,烧杯中阳离子向Zn极移动,且c(H+)减小,c(Cu2+)增大 |
16.下列有关金属冶炼的说法错误的是( )
| A. | 绝大多数金属的冶炼主要依据氧化还原反应原理 | |
| B. | 工业上可利用铝热反应炼铁 | |
| C. | 金属铝的冶炼可采取电解熔融氯化铝的方法 | |
| D. | 金属冶炼常会消耗许多能量,也易造成环境污染 |
13.85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.关于青蒿素和双氢青蒿素(结构如下)的下列说法,错误的是( )
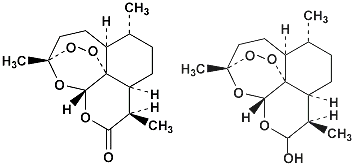

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
10.我国重点城市近年来已发布“空气质量日报”.下列物质中不列入首要污染物的是( )
| A. | 可吸入颗粒物 | B. | 二氧化碳 | C. | 二氧化硫 | D. | 二氧化氮 |
11.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 1molMgCl2中含有的离子数为2NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA |
 ,结构简式为CH2=CH2.
,结构简式为CH2=CH2. .
.