题目内容
6.300mL0.1mol•L-1Na2SO4溶液与100mL0.2mol•L-1Al2(SO4)3溶液中所含SO42-物质的量之比是( )| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 3:2 |
分析 根据n=cV分别计算300mL0.1mol•L-1Na2SO4溶液与100mL0.2mol•L-1Al2(SO4)3溶液中所含Na2SO4、Al2(SO4)3的物质的量,根据n(SO42-)=n(Na2SO4),n(SO42-)=3n[Al2(SO4)3],计算所含SO42-物质的量之比.
解答 解:300mL0.1mol•L-1Na2SO4溶液中,n(Na2SO4)=cV=0.1mol•L-1×0.3L=0.03mol,n(SO42-)=n(Na2SO4)=0.03mol,100mL0.2mol•L-1Al2(SO4)3溶液中,n[Al2(SO4)3]=cV=0.2mol•L-1×0.1L=0.02mol,n(SO42-)=3n[Al2(SO4)3]=0.06mol,所含SO42-物质的量之比0.03mol:0.06mol=1:2,
故选A.
点评 本题考查物质的量浓度有关计算,比较基础,难度不大,侧重对基础知识的巩固,注意理解电解质离子与电解质浓度关系.

练习册系列答案
相关题目
16.下列有关金属冶炼的说法错误的是( )
| A. | 绝大多数金属的冶炼主要依据氧化还原反应原理 | |
| B. | 工业上可利用铝热反应炼铁 | |
| C. | 金属铝的冶炼可采取电解熔融氯化铝的方法 | |
| D. | 金属冶炼常会消耗许多能量,也易造成环境污染 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 向密闭容器中通入0.1molN2和0.3molH2,在一定条件下充分反应,容器中N原子数为0.2NA | |
| B. | Cu-Zn-CuSO4原电池工作时,当转移电子数为0.2NA时,正极溶解Zn6.5g | |
| C. | 电解102g熔融的Al2O3,能产生54g金属铝和33.6LO2,转移电子数为6NA | |
| D. | 电解精炼铜当转移电子数为2NA时,阳极溶解的铜和阴极析出的铜均为64g |
11.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 1molMgCl2中含有的离子数为2NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA |
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色透明的溶液:Na+、Al3+、Cl-、OH- | |
| B. | pH=1的溶液:Na+、NH4+、Cu2+、NO3- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、Cl-、Al3+ | |
| D. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
4.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | Cl-的结构示意图  | B. | 铁红的化学式为Fe3O4 | ||
| C. | 甲醛的结构简式:CH2O | D. | CO2的电子式  |
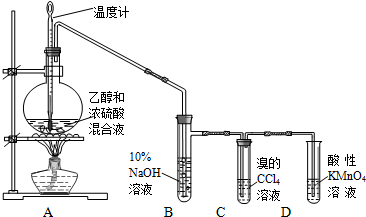 实验室制取乙烯并检验乙烯性质的装置如图.
实验室制取乙烯并检验乙烯性质的装置如图.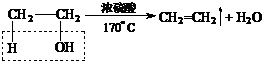 .
. 氢氧燃料电池的原理如图所示:回答下列问题
氢氧燃料电池的原理如图所示:回答下列问题 ;
;