题目内容
2.下列说法正确的是( )| A. | 乙烯、乙醇、过氧化钠、CaCl2都含有非极性键 | |
| B. | 乙醇、乙酸、水分子中均含有氢键 | |
| C. | 甲苯分子中共平面的原子最多有13个 | |
| D. | BF3、PCl3、CCl4、苯中所有原子全部满足最外层为8个电子结构 |
分析 A、CaCl2中只含离子键;
B、乙醇、乙酸、水分子间均存在氢键;
C、甲苯中苯基有11个原子共平面,甲基中最多有2个原子与苯基共平面;
D、在共价化合物中,判断成键原子的最外层是否满足8电子稳定结构,可根据原子的价电子数与化合物中的元素的化合价的绝对值之和判断.
解答 解:A、CaCl2中只含离子键,无非极性键,故A错误;
B、乙醇、乙酸、水分子间均存在氢键,而不是分子内氢键,故B错误;
C、甲苯中苯基有11个原子共平面,甲基中最多有2个原子与苯基共平面,最多有13个原子共平面,故C正确;
D、BF3中,B的价电子数为3,化合价为+3价,最外层数为3+3=6,不满足8电子稳定结构,苯环结构中的氢不满足8电子稳定结构,故D错误;
故选C.
点评 本题考查化学键和化合价问题,题目难度不大,注意判断核外是否满足8电子的结构的角度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.短周期主族元素X、Y、Z、W、R原子序数依次增大,X原子的最外层电子数是次外层的3倍,Y与X可形成离子化合物Y2X和Y2X2,Z所在的周期数等于族序数的位置,W的单质广泛用作半导体材料,R的常见化合价为-1、+1、+4、+5、+7.下列叙述不正确的是( )
| A. | WX2是生产光导纤维的原料 | |
| B. | RX2可用作自来水的消毒剂 | |
| C. | 工业上获得单质Y是用氢气热还原YR得到 | |
| D. | Y、Z、R的最高价氧化物的水化物两两之间均能发生反应 |
13.85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.关于青蒿素和双氢青蒿素(结构如下)的下列说法,错误的是( )
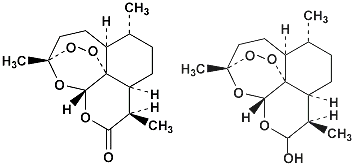

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
10.我国重点城市近年来已发布“空气质量日报”.下列物质中不列入首要污染物的是( )
| A. | 可吸入颗粒物 | B. | 二氧化碳 | C. | 二氧化硫 | D. | 二氧化氮 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 向密闭容器中通入0.1molN2和0.3molH2,在一定条件下充分反应,容器中N原子数为0.2NA | |
| B. | Cu-Zn-CuSO4原电池工作时,当转移电子数为0.2NA时,正极溶解Zn6.5g | |
| C. | 电解102g熔融的Al2O3,能产生54g金属铝和33.6LO2,转移电子数为6NA | |
| D. | 电解精炼铜当转移电子数为2NA时,阳极溶解的铜和阴极析出的铜均为64g |
7.下列说法正确的是( )
| A. | 实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 从海水中可以得到NaCl,电解NaCl溶液可以制备Na | |
| C. | 从海水中提取溴的工艺流程中溴蒸气被吸收剂SO2吸收的目的是将海水中的溴富集 | |
| D. | 海水中提取镁所涉及的化学反应全部是氧化还原反应 |
11.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 1molMgCl2中含有的离子数为2NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA |
20.一定温度下,W g下列物质在足量氧气中充分燃烧,产物与过量的Na2O2完全反应,Na2O2固体增重W g,符合此要求的组合是( )
①H2 ②CO ③CO和H2④HCOOCH3⑤OHC-CHO.
①H2 ②CO ③CO和H2④HCOOCH3⑤OHC-CHO.
| A. | 只有① | B. | 只有①②③ | C. | 只有①②③④ | D. | 都可以 |
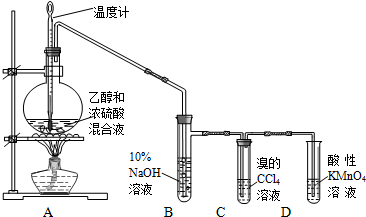 实验室制取乙烯并检验乙烯性质的装置如图.
实验室制取乙烯并检验乙烯性质的装置如图.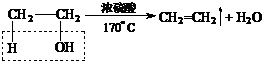 .
.