题目内容
4.下列微粒的核外电子排布式书写违反泡利原理的是( )| A. | C:1s22s22p2 | B. | Na+:1s22s22p43s2 | ||
| C. | S2-:1s22s22p23s23p4 | D. | K:1s22s22p63s23p7 |
分析 泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,s能级只有一个轨道,最多容纳2个电子,p能级上有3个轨道,最多可容纳6个电子.
解答 解:泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,s能级只有一个轨道,最多容纳2个电子,p能级上有3个轨道,最多可容纳6个电子.
A.C:1s22s22p2,符合泡利原理,故A不选;
B.Na+:1s22s22p43s2,符合泡利原理,故B不选;
C.根据能量最低原理,2p上的电子填满后,再填下一层,S2-正确的电子排布应是:1s22s22p63s23p6,故C不选;
D.K原子3p能级上有3个轨道,根据泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,3p能级上最多容纳6个电子,3p7违背了泡利原理,则K的核外电子排布应为:1s22s22p63s23p64s1,
故选D.
点评 本题考查了泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,明确这几个概念是解本题关键,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
7.下列说法正确的是( )
| A. | 实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 从海水中可以得到NaCl,电解NaCl溶液可以制备Na | |
| C. | 从海水中提取溴的工艺流程中溴蒸气被吸收剂SO2吸收的目的是将海水中的溴富集 | |
| D. | 海水中提取镁所涉及的化学反应全部是氧化还原反应 |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molMg变成Mg2+时失去的电子数为NA | |
| B. | 标准状况下,22.4L氮气含有的氮原子数为NA | |
| C. | 48gO3所含氧原子数为3NA | |
| D. | 18gH2O中所含的电子数我8NA |
11.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 1molMgCl2中含有的离子数为2NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA |
9.表是元素周期表一部分,列出了十个元素在周期表中的位置:
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程 .
.
(5)写出工业冶炼⑤的化学方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(6)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-═2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-;第三步Cl2+2Br-═2Cl-+Br2.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程
 .
.(5)写出工业冶炼⑤的化学方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(6)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-═2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-;第三步Cl2+2Br-═2Cl-+Br2.
16.金属活动性的强弱与人类开发利用这些金属单质的时间顺序有着某种内在联系.由此推断,下列金属中人类开发利用最早的是( )
| A. | Cu | B. | Fe | C. | Zn | D. | Al |
13.下列实验方案正确的是( )
| A. | 苯甲酸的提纯:将1g粗苯甲酸放到100mL的烧杯里,加入50mL水,加热完全溶解后趁 热过滤,静置冷却可析出苯甲酸晶体 | |
| B. | 除去苯中的苯酚杂质:向混有苯酚的苯中加入浓溴水,产生白色沉淀,再过滤 | |
| C. | 证明溴乙烷中溴元素的存在:向溴乙烷中加入NaOH溶液,共热,冷却后加入AgNO3溶液,产生浅黄色沉淀 | |
| D. | 银氨溶液的配制:向1mL 2%的稀氨水中逐滴滴加2%的AgNO3溶液 |
14.下列物质在常温常压下为液体的是( )
| A. | 甲烷 | B. | 一氯甲烷 | C. | 乙烯 | D. | 乙醇 |
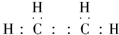 ,结构简式为CH2=CH2.
,结构简式为CH2=CH2. .
.