题目内容
滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是( )


| A、a、c | B、b、d |
| C、a、d | D、b、c |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲为原电池,发生吸氧腐蚀,铁易失电子作负极、碳作正极,负极电极反应式为Fe-2e-=Fe2+,正极电极反应式为O2+2H2O+4e-=4OH-,乙为电解池,铁作阴极、碳作阳极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,阳极电极反应式为2Cl--2e-=Cl2 ↑,据此分析解答.
解答:
解:甲为原电池,发生吸氧腐蚀,铁易失电子作负极、碳作正极,负极电极反应式为Fe-2e-=Fe2+,正极电极反应式为O2+2H2O+4e-=4OH-,乙为电解池,铁作阴极、碳作阳极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,阳极电极反应式为2Cl--2e-=Cl2 ↑,无色酚酞遇碱变红色,所以甲中正极附近生成氢氧根离子、乙中阴极附近生成氢氧根离子,所以电极附近溶液变红色的电极是bd,
故选B.
故选B.
点评:本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,根据电极反应式来确定选项即可,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
化学是一门以实验为基础的学科,掌握基本实验方法和操作技能是做好化学实验的基础.下列有关化学实验基本知识的描述不正确的是( )
| A、丁达尔现象可用于区别FeCl3饱和溶液和Fe(OH)3胶体 |
| B、过滤和蒸发操作中均用到玻璃棒,但玻璃棒的作用不相同 |
| C、汽油和水的混合物可用分液的方法分离 |
| D、检验某溶液中是否含有SO42-的方法是先向该溶液中加入BaCl2溶液,再加入稀HNO3 |
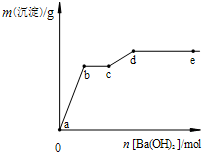 在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )
在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )| A、a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B、b→c时发生的离子反应为:H++OH-→H2O |
| C、c→d时离子的物质的量:Ba2+可能大于Cl- |
| D、d→e时离子的物质的量:Ba2+一定大于OH- |
电子表中电源常用银-锌微型电池,电极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-电池的总反应式为:Ag2O+Zn═2Ag+ZnO,下列判断不正确的是( )
| A、锌为负极,Ag2O为正极 |
| B、锌发生还原反应,氧化银发生氧化反应 |
| C、原电池工作时,负极附近溶液的pH值减小 |
| D、原电池工作时,电子流动方向为Zn→Ag2O |
叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一.下列有关说法正确的是( )
| A、NaN3中只含有离子键 |
| B、1mol NaN3完全分解最多可以产生33.6L N2 |
| C、当有4.2g N2生成时,转移电子数约为6.02×1022 |
| D、常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
 ( )
( )| A、置换反应 | B、水解反应 |
| C、中和反应 | D、电离过程 |
下列说法正确的是( )
| A、电子层数越多,原子半径一定越大 | ||||
B、已知2C+SiO2
| ||||
| C、第ⅥA族元素的氢化物中,稳定性最强的其沸点最低 | ||||
| D、按照元素周期表的排布规律,非金属元素最多为23种 |
在2A(g)+5B(g)?2C(g)+3D(g)反应中,下列反应速率最快的是( )
| A、υ(A)=0.8 mol/(L?s) |
| B、υ(B)=1.0 mol/(L?s) |
| C、υ(C)=1.8 mol/(L?min) |
| D、υ(D)=0.9 mol/(L?s) |