题目内容
23g Na投入到m g水中,充分反应后所得溶液中Na+与水分子的个数比为1:50,求m是多少(2Na+2H20=2NaOH+H2).
考点:化学方程式的有关计算
专题:计算题
分析:根据原子守恒可知n(Na+)=n(Na)=
=1mol,根据化学方程式、溶液中Na+与水分子的个数比为求出mg水的物质的量,带入m=nM计算.
| 23g |
| 23g/mol |
解答:
解:根据原子守恒可知n(Na+)=n(Na)=
=1mol,由2Na+2H20=2NaOH+H2可知,反应掉的水为1mol,由充分反应后所得溶液中Na+与水分子的个数比为1:50可知,溶液中水为1mol×50=50mol,因此mg水的物质的量为1mol+50mol=51mol,mg=51mol×18g/mol=918g,
答:m是918.
| 23g |
| 23g/mol |
答:m是918.
点评:本题考查了物质的量的相关计算,题目难度一般,注意不能忽略了氧化钠与水反应消耗的水的物质的量.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、NH4HCO3溶液与过量NaOH溶液反应 NH4++OH-═NH3↑+H2O |
| B、过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO |
| C、向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |


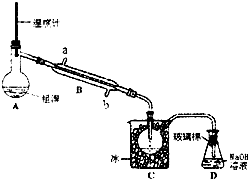 溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为: