题目内容
实验室中需要11.2L(标准状况)二氧化碳,现用含碳酸钙90%的石灰石与足量的稀盐酸反应(杂质不与稀盐酸反应),问:
(1)至少需要含碳酸钙90%的石灰石多少克?
(2)生成的氯化钙的物质的量是多少?
(1)至少需要含碳酸钙90%的石灰石多少克?
(2)生成的氯化钙的物质的量是多少?
考点:化学方程式的有关计算
专题:计算题
分析:(1)发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,根据n=
计算二氧化碳的物质的量,根据碳原子守恒计算n(CaCO3),再根据m=nM计算碳酸钙的质量,结合碳酸钙质量分数计算石灰石的质量;
(2)根据钙原子守恒计算氯化钙的物质的量.
| V |
| Vm |
(2)根据钙原子守恒计算氯化钙的物质的量.
解答:
解:(1)n(CO2)=
=0.5mol,根据碳原子守恒:n(CaCO3)=n(CO2)=0.5mol,碳酸钙的质量m=0.5mol×100g/mol=50g,故需要含碳酸钙90%的石灰石的质量=
=55.56g,
答:需要含碳酸钙90%的石灰石的质量是55.56g;
(2)根据钙原子守恒得n(CaCl2)=n(CaCO3)=0.5mol,
答:生成氯化钙的物质的量为0.5mol.
| 11.2L |
| 22.4L/mol |
| 50g |
| 90% |
答:需要含碳酸钙90%的石灰石的质量是55.56g;
(2)根据钙原子守恒得n(CaCl2)=n(CaCO3)=0.5mol,
答:生成氯化钙的物质的量为0.5mol.
点评:本题考查化学方程式的有关计算,注意根据原子守恒进行计算更简便,题目难度不大.

练习册系列答案
相关题目
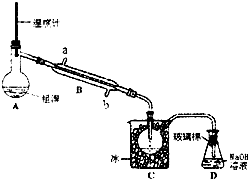 溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为: