题目内容
 I.铁盐、亚铁盐是实验室常用的药品.
I.铁盐、亚铁盐是实验室常用的药品.请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色.该反应的离子方程式为
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色.继续滴加双氧水,红色逐渐褪去,且有气泡产生.
写出上述变化中,有关反应的离子方程式:
①
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2
| SO | 2- 4 |
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理.
(5)实验前:①先用0.1mol?L-1H2SO4洗涤Fe粉,其目的是
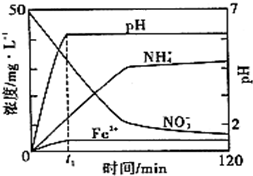
(6)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去).请根据图中信息写出t1时刻前该反应生成的阳离子分别是
t1时刻后,该反应仍在进行,溶液中NH+4的浓度在增大,Fe2+的浓度却没有增大,可能的原因是
考点:铁盐和亚铁盐的相互转变,离子方程式的书写,铁的氧化物和氢氧化物,性质实验方案的设计
专题:实验设计题,元素及其化合物
分析:(1)碘离子具有还原性,铁离子具有氧化性,二者之间可以发生氧化还原反应;
(2)双氧水具有氧化性,能将亚铁离子氧化;化学反应中,化合价变化数值=转移电子数,根据电子守恒来计算;
(3)根据氧化还原反应中还原剂的还原性强于还原产物的还原性、氧化剂优先氧化还原性强的还原剂来回答;
(4)根据催化剂的特点,恢复原来状态,Fe3+→Fe2+;
(5)铁表面有铁锈加入硫酸可除去,除去溶液中的氧气,可向溶液中通入氮气;
(6)根据图象判断出离子浓度减小的有H+、NO3-,增大的有Fe2+ 和NH4+,故反应物为Fe和H+、NO3-,生成物为Fe2+ 和NH4+,可写出化学方程式为4Fe+NO3-+10H+═4Fe2++NH4++3H2O;Fe2+水解呈酸性,当溶液中PH较大时会促进Fe2+水解.
(2)双氧水具有氧化性,能将亚铁离子氧化;化学反应中,化合价变化数值=转移电子数,根据电子守恒来计算;
(3)根据氧化还原反应中还原剂的还原性强于还原产物的还原性、氧化剂优先氧化还原性强的还原剂来回答;
(4)根据催化剂的特点,恢复原来状态,Fe3+→Fe2+;
(5)铁表面有铁锈加入硫酸可除去,除去溶液中的氧气,可向溶液中通入氮气;
(6)根据图象判断出离子浓度减小的有H+、NO3-,增大的有Fe2+ 和NH4+,故反应物为Fe和H+、NO3-,生成物为Fe2+ 和NH4+,可写出化学方程式为4Fe+NO3-+10H+═4Fe2++NH4++3H2O;Fe2+水解呈酸性,当溶液中PH较大时会促进Fe2+水解.
解答:
解:(1)向酸化的FeCl3溶液中逐滴加入KI溶液,碘离子具有还原性,铁离子具有氧化性,二者之间可以发生氧化还原反应:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(2)①双氧水具有氧化性,能将亚铁离子氧化,即:H2O2+2H++2Fe2+=2Fe3++2H2O,故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;
③在发生的反应③中O元素化合价由-1价变为-2价,S元素化合价由-2价变为+6价、N元素化合价由-3价变为0价,得失电子最小公倍数是22,即转移电子是22mol,故答案为:22;
(3)根据(1)发生的反应得到还原性是I->Fe2+,根据反应①②可以得出还原性是:Fe2+>SCN-,即还原性顺序是:I->Fe2+>SCN-,故答案为:I->Fe2+>SCN-;
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+.
(5)H2SO4可以除去Fe粉表面的氧化物;为防止空气中的O2对脱氮的影响,可向KNO3溶液中通入N2,排出O2.故答案为:去除铁粉表面的氧化物等杂质; N2;
(6)t1时刻前H+、NO3- 浓度减小,Fe2+ 和NH4+的浓度增大,故反应的离子方程式为4Fe+NO3-+10H+═4Fe2++NH4++3H2O,生成的阳离子是:Fe2+、NH4+,Fe粉足量,反应仍在进行,Fe2+的浓度没有增大的原因是发生了水解反应,因为溶液的pH增大,促进了水解.故答案为:Fe2+;NH4+;生成的Fe2+水解(或和溶液中的OH-反应).
(2)①双氧水具有氧化性,能将亚铁离子氧化,即:H2O2+2H++2Fe2+=2Fe3++2H2O,故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;
③在发生的反应③中O元素化合价由-1价变为-2价,S元素化合价由-2价变为+6价、N元素化合价由-3价变为0价,得失电子最小公倍数是22,即转移电子是22mol,故答案为:22;
(3)根据(1)发生的反应得到还原性是I->Fe2+,根据反应①②可以得出还原性是:Fe2+>SCN-,即还原性顺序是:I->Fe2+>SCN-,故答案为:I->Fe2+>SCN-;
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+.
(5)H2SO4可以除去Fe粉表面的氧化物;为防止空气中的O2对脱氮的影响,可向KNO3溶液中通入N2,排出O2.故答案为:去除铁粉表面的氧化物等杂质; N2;
(6)t1时刻前H+、NO3- 浓度减小,Fe2+ 和NH4+的浓度增大,故反应的离子方程式为4Fe+NO3-+10H+═4Fe2++NH4++3H2O,生成的阳离子是:Fe2+、NH4+,Fe粉足量,反应仍在进行,Fe2+的浓度没有增大的原因是发生了水解反应,因为溶液的pH增大,促进了水解.故答案为:Fe2+;NH4+;生成的Fe2+水解(或和溶液中的OH-反应).
点评:本题考查元素化合物的性质、氧化还原反应方程式的书写以及电子转移情况,综合性较强,设计实验步骤,注意语言的条理性和严密性.

练习册系列答案
相关题目
下列物质中,存在的化学键种类最多的是( )
| A、NaOH |
| B、HClO |
| C、MgCl2 |
| D、NH4Cl |
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 制取干燥的氨气 |
B、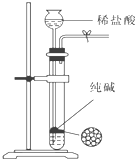 可用于制取少量纯净的CO2气体 |
C、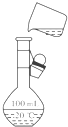 将溶液定容到100mL |
D、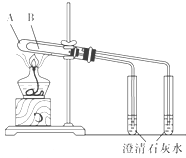 可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体 |