题目内容
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:根据X2+和Z-离子的电子数之差为8,由元素周期表确定X2+为Be2+或Mg2+;推断Z为F-或Cl-;依据W和X元素原子内质子数之比为1:2,判断W为He或C,结合原子最外层电子数之和为19,所以两种判断中:W:He;X:Be;Z:F时,Y的最外层电子数为8,因为W、X、Y、Z的原子序数依次增大,所以不符合;若各元素为W:C:X:Mg;Z:Cl;由最外层电子数之和为19,Y的最外层电子数为6,确定Y为S,综上所述:推断出各物质为:W、C;X、Mg;Y、S;Z、Cl,以此解答该题.
解答:
解:根据X2+和Z-离子的电子数之差为8,由元素周期表确定X2+为Be2+或Mg2+;推断Z为F-或Cl-;依据W和X元素原子内质子数之比为1:2,判断W为He或C,结合原子最外层电子数之和为19,所以两种判断中:W:He;X:Be;Z:F时,Y的最外层电子数为8,因为W、X、Y、Z的原子序数依次增大,所以不符合;若各元素为W:C:X:Mg;Z:Cl;由最外层电子数之和为19,Y的最外层电子数为6,确定Y为S,综上所述:推断出各物质为:W、C;X、Mg;Y、S;Z、Cl,
A.与碳同主族的元素硅是良好的半导体材料,故A正确;
B.Mg可在二氧化碳中燃烧生成C和MgO,故B错误;
C.同一周期中,原子半径随着原子序数的增大而减小,所以Mg、S、Cl的原子半径逐渐减小,故C正确;
D.非金属元素最强的元素是Cl元素,所以W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2ZO4,故D正确.
故选B.
A.与碳同主族的元素硅是良好的半导体材料,故A正确;
B.Mg可在二氧化碳中燃烧生成C和MgO,故B错误;
C.同一周期中,原子半径随着原子序数的增大而减小,所以Mg、S、Cl的原子半径逐渐减小,故C正确;
D.非金属元素最强的元素是Cl元素,所以W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2ZO4,故D正确.
故选B.
点评:本题考查原子结构与元素周期律的关系,根据原子结构明确元素种类为解答该题的关键,注意把握原子结构特点以及元素周期律的递变规律,为解答该题的关键,题目难度中等.

练习册系列答案
相关题目
常温下,下列各溶液的叙述不正确的是( )
| A、pH=7的氨水和氯化铵混合溶液中c(NH4+)=c(Cl-) |
B、浓度均为0.1mol?L-1的 溶液和CH3COONa溶液中,溶液中c( 溶液和CH3COONa溶液中,溶液中c( )<c(CH3COO-) )<c(CH3COO-) |
| C、pH=3的硫酸溶液和pH=11的氨水溶液等体积混合,混合后溶液显碱性 |
| D、已知酸性HF>CH3COOH,则等体积等物质的量浓度的NaF和CH3COONa溶液所含的阴离子数后者较多 |
下列反应中不属于氧化还原反应的是( )
| A、Cl2+2NaOH═NaCl+NaClO+H2O |
| B、NH3+HCl═NH4Cl |
| C、Br2+2KI═I2+2KBr |
| D、CO2+Ca(OH)2═CaCO3+H2O |
钛被称为21世纪金属.研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置制备金属钛.下列叙述正确的是( )


| A、乙装置阴极的电极反应式为TiO2+4e-═Ti+2O2- |
| B、若不考虑能量的损失,制备24.0g金属钛,需要消耗金属铝36.0g |
| C、甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D、乙装置中的石墨电极需要定期更换 |
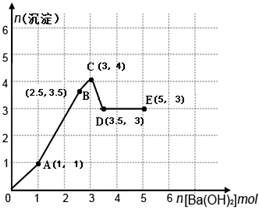 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A、O→A:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| B、A→B:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、B→C:2NH4++SO42-+Ba2++2OH-→BaSO4↓+2NH3?H2O |
| D、D→E:NH4++OH-→NH3?H2O |
 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )| A、Be Na Al |
| B、B Mg Si |
| C、O P Cl |
| D、C Al P |
在体积不变的400℃恒温密闭容器中,一定量的SO2与1mol O2在催化剂作用下发生反应:2SO2(g)+O2(g)
2SO3(g)+QkJ.当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| 催化剂 |
| 加热 |
| A、增大氧气浓度,平衡向正方向移动,K值不变 |
| B、降低温度,正反应速率比逆反应速率减小的程度小 |
| C、平衡时SO2气体的转化率为50% |
| D、该条件下反应放出0.5QkJ的热量 |