题目内容
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4mol?L-1NaOH溶液反应,用去40mLNaOH溶液时恰好完全中和.试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10mL原混合液,加入1.92g铜粉共热时,收集到气体在标准状况下的体积为多少毫升?
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10mL原混合液,加入1.92g铜粉共热时,收集到气体在标准状况下的体积为多少毫升?
考点:离子方程式的有关计算
专题:计算题
分析:(1)酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,根据n=
计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与4.0mol?L-1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=
计算硫酸、硝酸的物质的量浓度;
(2)根据离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,过量问题的判断,根据少的来求解.
| m |
| M |
| n |
| V |
(2)根据离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,过量问题的判断,根据少的来求解.
解答:
解:(1)硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,
硫酸根守恒故n(H2SO4)=n(BaSO4)=
=0.04mol,故原溶液中c(H2SO4)=
=4mol/L;
滤液中氢离子物质的量不变,与4.0mol?L-1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),即n(HNO3)+2×0.04mol=0.04L×4mol/L,解得n(HNO3)=0.08mol,故原溶液中c(HNO3)=
=8mol/L,
答:混合液中H2SO4的物质的量浓度为4mol/L、HNO3的物质的量浓度是8mol/L;
(2)1.92g铜粉物质的量为0.03mol,溶液中氢离子的物质的量为10×10-3×(4×2+8×1)mol=0.16mol,根据离子方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
3mol 8mol 44.8L
0.03mol 0.16mol V
由此可知氢离子过量,则
=
,
V=0.448L,
答:收集到气体在标准状况下的体积为0.448L.
硫酸根守恒故n(H2SO4)=n(BaSO4)=
| 9.32g |
| 233g/mol |
| 0.04mol |
| 0.01L |
滤液中氢离子物质的量不变,与4.0mol?L-1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),即n(HNO3)+2×0.04mol=0.04L×4mol/L,解得n(HNO3)=0.08mol,故原溶液中c(HNO3)=
| 0.08mol |
| 0.01L |
答:混合液中H2SO4的物质的量浓度为4mol/L、HNO3的物质的量浓度是8mol/L;
(2)1.92g铜粉物质的量为0.03mol,溶液中氢离子的物质的量为10×10-3×(4×2+8×1)mol=0.16mol,根据离子方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
3mol 8mol 44.8L
0.03mol 0.16mol V
由此可知氢离子过量,则
| 3mol |
| 0.03mol |
| 44.8L |
| V |
V=0.448L,
答:收集到气体在标准状况下的体积为0.448L.
点评:本题考查混合物的有关计算,难度中等,注意根据加入氯化钡反应后溶液中氢离子的物质的量不变.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 |
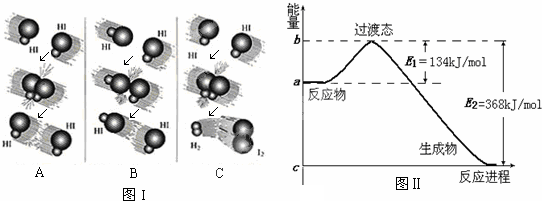



 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1