题目内容
 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A、O→A:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| B、A→B:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、B→C:2NH4++SO42-+Ba2++2OH-→BaSO4↓+2NH3?H2O |
| D、D→E:NH4++OH-→NH3?H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,A(1,1)可知,发生硫酸和氢氧化钡的离子反应;A→B发生硫酸根离子、铝离子与氢氧化钡的离子反应生成两种沉淀;B→C发生铵根离子、硫酸根离子与氢氧化钡飞离子反应;C→D发生氢氧化铝的溶解离子反应;D→E没有离子反应发生.
解答:
解:A.O→A的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A错误;
B.A→B的离子反应为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故B正确;
C.B→C的离子反应为2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3?H2O,故C正确;
D.D→E没有离子反应发生,不能写出离子反应,故D错误;
故选BC.
B.A→B的离子反应为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故B正确;
C.B→C的离子反应为2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3?H2O,故C正确;
D.D→E没有离子反应发生,不能写出离子反应,故D错误;
故选BC.
点评:本题考查离子反应方程式书写的正误判断及图象分析,为高频考点,把握反应的先后顺序及图象中对应的离子反应为解答的关键,侧重分析能力及复分解反应的先后顺序考查,题目难度较大.

练习册系列答案
相关题目
如图实验装置设计,能达到目的是( )
A、 验证乙酸、碳酸和苯酚的酸性强弱 |
B、 实验室制取乙酸丁酯 |
C、 测定乙醇结构式 |
D、 验证溴乙烷中的溴原子 |
X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z最外层电子数之和为10,下列说法正确的是( )
| A、Y的最高价氧化物对应的水化物一定是碱 |
| B、稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物 |
| C、若X、Y、W形成的化合物为XYW2,则其水溶液显酸性 |
| D、X、Y的氧化物晶体类型不一定相同 |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 |
下列表述与示意图相符的是( )


| A、正反应为吸热反应 | ||
| B、升高温度,有利于反应向正方向进行 | ||
| C、A点时,反应向逆反应方向移动 | ||
D、K正与K逆的关系是:K正=
|
常温下,有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、四种溶液的pH的大小顺序:①>④>③>② |
| B、将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>② |
| D、将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
 )是一种医药中间体,用茴香醛(
)是一种医药中间体,用茴香醛(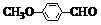 )经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
)经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
 转化为
转化为 ,其合成线路如下:
,其合成线路如下: 写(Ⅱ)(Ⅲ)两步反应的化学方程式:
写(Ⅱ)(Ⅲ)两步反应的化学方程式: