题目内容
 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )| A、Be Na Al |
| B、B Mg Si |
| C、O P Cl |
| D、C Al P |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,A位于第二周期,B和C位于第三周期,B、C两元素在周期表中族序数之和是A元素族序数的2倍,则B、A、C族序数相邻;A的原子序数与其同主族第三周期元素原子序数相差8.
解答:
解:据元素在周期表中的位置知,A位于第二周期,B和C位于第三周期,B、C两元素在周期表中族序数之和是A元素族序数的2倍,则B、A、C族序数相邻;A的原子序数与其同主族第三周期元素原子序数相差8,B、C元素的原子序数之和是A元素原子序数的4倍,设A的原子序数是x,则B的原子序数是x+7、C的原子序数是x+9,x+7+x+9=4x,x=8,则A是O元素、B是P元素、C是Cl元素,
故选C.
故选C.
点评:本题考查了元素周期表和元素周期律的综合应用,熟悉元素周期表结构及原子结构是解本题关键,再结合原子序数之间的关系确定元素,题目难度不大.

练习册系列答案
相关题目
在一个不传热的固定容积的密闭容器中,可逆反应N2(气)+3H2(气)?2NH3(气),达到平衡的标志是:①反应速率υ(N2):υ(H2):υ(NH3)=1:3:2;②各组分的物质的量浓度不再改变;③体系的压强不再发生变化;④混合气体的密度不变(相同状况);⑤体系的温度不再发生变化;⑥2υ(N2)(正反应)=υ(NH3)(逆反应)⑦单位时间内3molH-H断键反应同时2molN-H也断键反应( )
| A、①②③⑤⑥ | B、②③④⑤⑥ |
| C、②③④⑥⑦ | D、②③⑤⑥ |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 |
科学家根据自然界存在的N2制取N3,其后又陆续制取出N5、含N5+的化合物及N60.N5+极不稳定,需保存在-80℃的干冰中;N5+由于其极强的爆炸性,又称为“盐粒炸弹”;N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来.分析上述材料,下列说法中不正确的是( )
| A、N5+常温下会剧烈爆炸,体积急剧膨胀,放出大量的热 |
| B、N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料 |
| C、N2、N3、N5、N5+、N60互为同素异形体 |
| D、含N5+的化合物中既有离子键又有共价键 |
常温下,有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、四种溶液的pH的大小顺序:①>④>③>② |
| B、将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>② |
| D、将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
下列说法或表达中,正确的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A、少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO |
| B、过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 |
| C、结合质子能力由强到弱的顺序为:CO32->CN->HCO3->CH3COO- |
| D、常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |
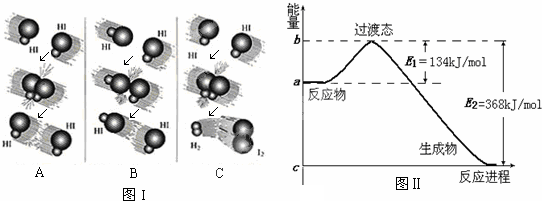
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1