题目内容
在体积不变的400℃恒温密闭容器中,一定量的SO2与1mol O2在催化剂作用下发生反应:2SO2(g)+O2(g)
2SO3(g)+QkJ.当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| 催化剂 |
| 加热 |
| A、增大氧气浓度,平衡向正方向移动,K值不变 |
| B、降低温度,正反应速率比逆反应速率减小的程度小 |
| C、平衡时SO2气体的转化率为50% |
| D、该条件下反应放出0.5QkJ的热量 |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:依据反应前后气体物质的量变化可知反应前后气体物质的量减小为反应的氧气物质的量;结合化学反应三段式列式计算,设二氧化硫起始量为x;
2SO2(g)+O2(g)
2SO3(g)+QkJ
起始量(mol) x 1 0
变化量(mol) 0.25 0.5 0.25
平衡量(mol) x-0.25 0.5 0.25
依据化学平衡移动原理分析判断.
2SO2(g)+O2(g)
| 催化剂 |
| 加热 |
起始量(mol) x 1 0
变化量(mol) 0.25 0.5 0.25
平衡量(mol) x-0.25 0.5 0.25
依据化学平衡移动原理分析判断.
解答:
解:A、增大压强浓度,增大反应物浓度,平衡正向进行,但温度不变,平衡常数不变,故A正确;
B、降低温度反应速率减小,正逆反应速率减小,反应是放热反应,平衡正向进行,正向反应速率减小的少,故B正确;
C、二氧化硫的起始量不知不能计算转化率,故C错误;
D、依据反应放热,1mol氧气反应放热QKJ,反应了0.5mol氧气,放热0.5QKJ,故D正确;
故选C.
B、降低温度反应速率减小,正逆反应速率减小,反应是放热反应,平衡正向进行,正向反应速率减小的少,故B正确;
C、二氧化硫的起始量不知不能计算转化率,故C错误;
D、依据反应放热,1mol氧气反应放热QKJ,反应了0.5mol氧气,放热0.5QKJ,故D正确;
故选C.
点评:本题考查了化学平衡影响因素和反应热量变化的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 |
常温下,有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、四种溶液的pH的大小顺序:①>④>③>② |
| B、将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>② |
| D、将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
下列说法或表达中,正确的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A、少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO |
| B、过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 |
| C、结合质子能力由强到弱的顺序为:CO32->CN->HCO3->CH3COO- |
| D、常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
 )是一种医药中间体,用茴香醛(
)是一种医药中间体,用茴香醛(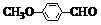 )经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
)经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
 转化为
转化为 ,其合成线路如下:
,其合成线路如下: 写(Ⅱ)(Ⅲ)两步反应的化学方程式:
写(Ⅱ)(Ⅲ)两步反应的化学方程式: