题目内容
19.化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是( )| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
分析 A.平衡常数的大小只与温度有关;
B.组成结构相似的物质,溶度积越小,越易生成沉淀;
C.升高温度促进弱酸的电离;
D.无论反应是否达到平衡,化学平衡常数都不会发生变化.
解答 解:A.平衡常数的大小只与温度有关,而与浓度、压强、催化剂等无关,故A错误;
B.AgCl、AgI是组成结构相似的物质,因为 Ksp(AgCl)>Ksp(AgI),所以可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生,故B正确;
C.弱电解质的电离过程是吸热过程,升高温度促进弱酸的电离,因此当温度升高时,弱酸的电离平衡常数Ka变大,故C错误;
D.无论反应是否达到平衡,化学平衡常数都不会发生变化,因此不能根据化学平衡常数来判断化学反应已达化学平衡状态,故D错误.
故选B.
点评 本题考查了重要的各类平衡常数的影响因素和综合应用,为高频考点,侧重于学生的分析能力的考查,主要考查弱电解质的电离平衡是些过程,沉淀转化的依据,电离平衡常数的应用,难度不大.

练习册系列答案
相关题目
12.下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是( )
| A. | 前者是混合物,后者是纯净物 | |
| B. | 两者都具有丁达尔效应 | |
| C. | 分散质的粒子直径均在1~100nm之间 | |
| D. | 前者可用于杀菌,后者可用于净水 |
7.一氯代烃A(C5H11Cl)经水解后再氧化可得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B 和C可发生酯化反应生成酯D,则D可能的结构有( )种.
| A. | 12 | B. | 16 | C. | 24 | D. | 32 |
14.T℃时,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线如图所示.则下列说法错误的是( )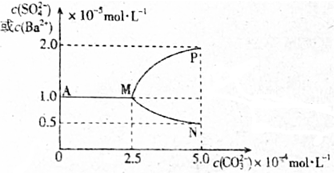

| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
4.下列不能用勒沙特列原理解释的是( )
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③SO2催化氧化成SO3的反应,往往需要使用催化剂
④H2、I2、HI平衡混和气加压后颜色变深
⑤光照氯水,颜色变浅
⑥向盛有NO2的集气瓶中投入活性炭,颜色变浅
⑦加热氯化铁溶液,溶液变红.
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③SO2催化氧化成SO3的反应,往往需要使用催化剂
④H2、I2、HI平衡混和气加压后颜色变深
⑤光照氯水,颜色变浅
⑥向盛有NO2的集气瓶中投入活性炭,颜色变浅
⑦加热氯化铁溶液,溶液变红.
| A. | ②③④ | B. | ①②⑥ | C. | ④⑤⑦ | D. | ③④⑥ |
11.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硝酸银溶液与铁粉反应:2Ag++Fe═Fe2++2Ag | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
8.以下物质间的每步转化通过一步反应就能实现的是( )
| A. | S→SO3→H2SO4 | B. | Fe→FeCl3→FeCl2 | ||
| C. | Si→H2SiO3→Na2SiO3 | D. | Al2O3→Al(OH)3→NaAlO2 |