题目内容
11.下列反应的离子方程式书写正确的是( )| A. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硝酸银溶液与铁粉反应:2Ag++Fe═Fe2++2Ag | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
分析 A.不符合离子的配比;
B.反应生成硫酸亚铁和氢气;
C.电子、电荷守恒;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.氢氧化钡溶液与稀 H2SO4 反应的离子反应为Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故A错误;
B.稀 H2SO4与铁粉反应的离子反应为Fe+2H+═Fe2++H2↑,故B错误;
C.硝酸银溶液与铁粉反应的离子反应为2Ag++Fe═Fe2++2Ag,故C正确;
D.碳酸钙与盐酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
4.下列说法不正确的是( )
| A. | 石油的裂解可以提高汽油等轻质油的质量和产量 | |
| B. | 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 葡萄糖、淀粉、油脂在一定条件下都能发生水解反应 | |
| D. | 往蛋白质溶液中加入饱和硫酸铵溶液,产生的沉淀再加水又可溶解 |
19.化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是( )
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
6.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
16.下列叙述正确的是( )
| A. | 加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 鉴别碳酸钠溶液和碳酸氢钠溶液,可以用稀CaCl2 溶液 | |
| C. | 做焰色反应时,每次实验要将铂丝用水洗干净,再蘸取其他物质在灯焰上灼烧 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
3.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的体系( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会析出黑色沉淀.
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会析出黑色沉淀.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
20.二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
403K时,该反应的平衡常数为400
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
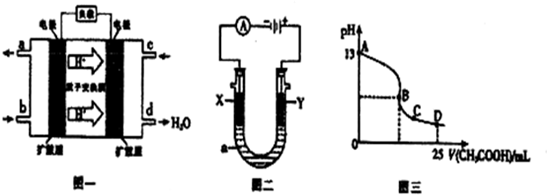
(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ、二甲醚燃料电池的工作原理如图一所示.

(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
1.下列说法正确的是( )
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸(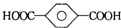 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (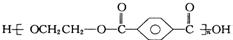 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |