题目内容
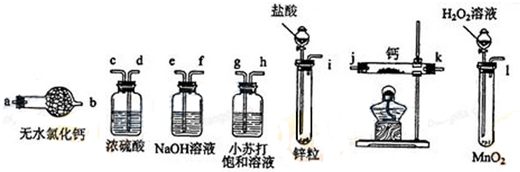
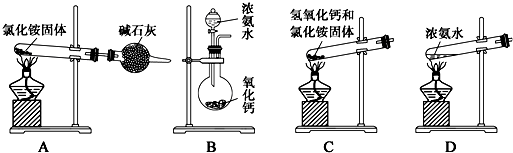
10.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某小组模拟制备氨基甲酸铵的反应为:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.(温度对反应的影响比较灵敏)(1)如用下图装置和选用的试剂制取氨气,其中错误的是AC;氨气的实验室制法的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3 ↑+CaCl2+2H2O.
(2)制备氨基甲酸铵的装置如下图所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.(注:CCl4与液体石蜡均为惰性介质.)
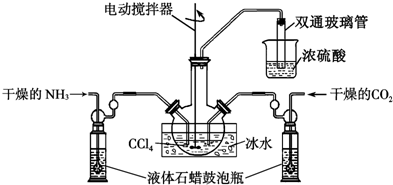
①发生器用冰水冷却的原因是降温提高反应物转化率、防止产物分解;液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例;
双通玻璃管的作用是防止倒吸;浓硫酸的作用是吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).
为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.请利用下列试剂,设计实验方案,对制得的氨基甲酸铵中的杂质进行成分探究.取少量固体样品于试管中,加入蒸馏水至固体溶解,向试管中加入过量的BaCl2溶液,若溶液不变浑浊,证明固体中不含碳酸铵,否则含有碳酸铵;取试管中的上层清液,滴加澄清石灰水,若变浑浊,证明固体中含有碳酸氢铵,否则不含碳酸氢铵
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
分析 本题是探究模拟工业原理制备氨基甲酸铵,涉及利用浓氨水与氢氧化钠固体制备氨气,再将氨气和二氧化碳通入四氯化碳中,不断搅拌混合生成氨基甲酸铵,因反应是放热反应,为了防止产物因温度高分解及提高反应物的转化率,选择利用冰水进行水浴降温,另外还涉及到产品的提纯及尾气的处理,
(1)A、装置中氯化铵受热分解生成氨气和氯化氢,氨气和氯化氢在冷却时又结合成氯化铵,会堵塞导管;
B、将浓氨水滴入氧化钙中,氧化钙与水反应放热,促使氨气挥发,可以制得氨气;
C、氯化铵与氢氧化钙加热分解生成氨气,同时有水生成,试管口高于试管底,水会流入试管底部,会使试管破裂;
D、浓氨水加热,促使氨气挥发,可以制得氨气;
实验室用氯化铵与氢氧化钙加热制得氨气;
(2)①反应是放热反应降温平衡正向进行,液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸;实验中有未反应的氨气会污染空气,所以要进行尾气吸收,同时要防止空气中的水蒸气进入装置使氨基甲酸铵水解;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,利用过滤得到的氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,应选择低温干燥;
(3)根据实验目的,检验氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种,通过向试管中加入过量的BaCl2溶液,静置溶液不变浑浊,证明固体中不含碳酸铵;在不含碳酸铵的基础上在通过向试管中加入少量澄清石灰水,看溶液是否变浑浊证明固体中是否含有碳酸氢铵.
解答 解:本题是探究模拟工业原理制备氨基甲酸铵,涉及利用浓氨水与氢氧化钠固体制备氨气,再将氨气和二氧化碳通入四氯化碳中,不断搅拌混合生成氨基甲酸铵,因反应是放热反应,为了防止产物因温度高分解及提高反应物的转化率,选择利用冰水进行水浴降温,另外还涉及到产品的提纯及尾气的处理,
(1)A、装置中氯化铵受热分解生成氨气和氯化氢,氨气和氯化氢在冷却时又结合成氯化铵,会堵塞导管,故A有错误;
B、将浓氨水滴入氧化钙中,氧化钙与水反应放热,促使氨气挥发,可以制得氨气,故B正确;
C、氯化铵与氢氧化钙加热分解生成氨气,同时有水生成,试管口高于试管底,水会流入试管底部,会使试管破裂,故C有错误;
D、浓氨水加热,促使氨气挥发,可以制得氨气,故D正确;
故选AC;
实验室用氯化铵与氢氧化钙加热制得氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3 ↑+CaCl2+2H2O,
故答案为:AC;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3 ↑+CaCl2+2H2O;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,双通玻璃管的作用是防止液体倒吸,实验中有未反应的氨气会污染空气,所以浓硫酸的作用是吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解,
故答案为:降温提高反应物转化率、防止产物分解;通过观察气泡,调节NH3与CO2通入比例;防止倒吸;吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,利用过滤得到的氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,故选c,故答案为:过滤;c;
(3)根据实验目的,检验氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种,实验操作为取少量固体样品于试管中,加入蒸馏水至固体溶解,向试管中加入过量的BaCl2溶液,若溶液不变浑浊,证明固体中不含碳酸铵,否则含有碳酸铵;取试管中的上层清液,滴加澄清石灰水,若变浑浊,证明固体中含有碳酸氢铵,否则不含碳酸氢铵,
故答案为:取少量固体样品于试管中,加入蒸馏水至固体溶解,向试管中加入过量的BaCl2溶液,若溶液不变浑浊,证明固体中不含碳酸铵,否则含有碳酸铵;取试管中的上层清液,滴加澄清石灰水,若变浑浊,证明固体中含有碳酸氢铵,否则不含碳酸氢铵.
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案Fe(s)+H2O (g)?FeO(s)+H2 (g)△H2 平衡常数为K2
在不同温度时K1、K2的值如表:
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A. | △H=△H1-△H2 | |
| B. | K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 该反应进行时不断分离出H2O,可以提高CO2的转化率和反应速率 | |
| D. | 该反应正反应为吸热反应 |
| A. | 石油的裂解可以提高汽油等轻质油的质量和产量 | |
| B. | 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 葡萄糖、淀粉、油脂在一定条件下都能发生水解反应 | |
| D. | 往蛋白质溶液中加入饱和硫酸铵溶液,产生的沉淀再加水又可溶解 |
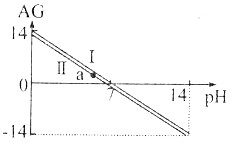
| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
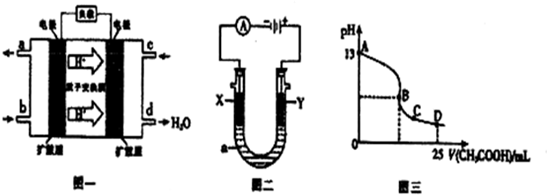
(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).