题目内容
7.一氯代烃A(C5H11Cl)经水解后再氧化可得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B 和C可发生酯化反应生成酯D,则D可能的结构有( )种.| A. | 12 | B. | 16 | C. | 24 | D. | 32 |
分析 一氯代烃A(C5H11Cl)经水解后再氧化得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B和C可发生酯化反应生成酯D,则B为羧酸,分子式为C4H9COOH、C为醇,分子式为C4H9OH,且含有相同的碳原子数目,分析-C4H9的异构种类,乘积即为D可能的结构种数.
解答 解:一氯代烃A(C5H11Cl)经水解后再氧化得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B和C可发生酯化反应生成酯D,则B为羧酸,分子式为C4H9COOH、C为醇,分子式为C4H9OH,且含有相同的碳原子数目.
-C4H9的异构情况为正丁基:-CH2CH2CH2CH3、
异丁基:-CH2CH(CH3)2、
仲丁基:-CH(CH3)-CH2-CH3、
叔丁基:-C(CH3)3共4种,
说明BC有4种可能结构;
D可能的结构有4×4=16种,
故选B.
点评 本题考查有机物推断,涉及同分异构体、卤代烃及醇、羧酸、酯的性质,掌握官能团的性质与转化是解题基础,正确判断同分异构体的种类是关键,难度中等,注意掌握同分异构体的解题方法.

练习册系列答案
相关题目
20.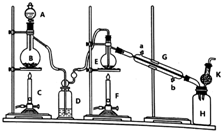 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
某同学设计的相关实验装置图如图:
(l)A中浓盐酸与B中物质进行反应,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中的试剂为浓硫酸,目的是除去H2O.
(3)G中冷却水的进水位置为b(填字母).
(4)为避免E中副反应的发生,对装置需要改进的措施是BD间增加盛饱和食盐水的洗气瓶.
(5)K中固体物质的作用为防止空气中水分进入.
(6)当要结束实验时,不能首先进行的操作是③.①关闭A的活塞 ②停止F的加热 ③停止G的通水.
(7)若将B中的固体换成Sn,并将除A和B以外的器皿去掉,反应可制备SnCl2.
(8)实验结束后,若得到的SnCl4为13.05g,至少消耗8.70g MnO2.为了避免尾气污染,需要改进的措施是在K后面加尾气吸收装置.
 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
(l)A中浓盐酸与B中物质进行反应,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中的试剂为浓硫酸,目的是除去H2O.
(3)G中冷却水的进水位置为b(填字母).
(4)为避免E中副反应的发生,对装置需要改进的措施是BD间增加盛饱和食盐水的洗气瓶.
(5)K中固体物质的作用为防止空气中水分进入.
(6)当要结束实验时,不能首先进行的操作是③.①关闭A的活塞 ②停止F的加热 ③停止G的通水.
(7)若将B中的固体换成Sn,并将除A和B以外的器皿去掉,反应可制备SnCl2.
(8)实验结束后,若得到的SnCl4为13.05g,至少消耗8.70g MnO2.为了避免尾气污染,需要改进的措施是在K后面加尾气吸收装置.
1.可以用AG来表示溶液的酸度.AG与pH的关系如图:则下列说法正确的是( )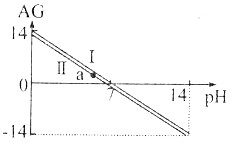

| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
12.向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag.下列结论错误的是( )
| A. | 溶液中Cu2+与Fe2+的物质的量比为1:2 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 氧化性:Zn2+>Cu2+>Fe3+>Ag+ | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
19.化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是( )
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
16.下列叙述正确的是( )
| A. | 加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 鉴别碳酸钠溶液和碳酸氢钠溶液,可以用稀CaCl2 溶液 | |
| C. | 做焰色反应时,每次实验要将铂丝用水洗干净,再蘸取其他物质在灯焰上灼烧 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
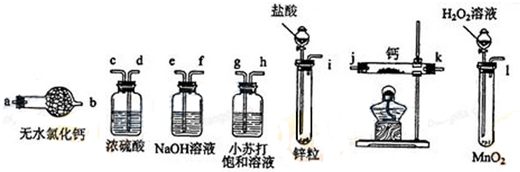
17.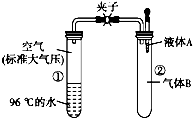 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |