题目内容
12.下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是( )| A. | 前者是混合物,后者是纯净物 | |
| B. | 两者都具有丁达尔效应 | |
| C. | 分散质的粒子直径均在1~100nm之间 | |
| D. | 前者可用于杀菌,后者可用于净水 |
分析 A.溶液和胶体都是分散系;
B.胶体能发生丁达尔效应,而溶液不能;
C.根据溶液和胶体粒子半径大小不同,直径范围不一样;
D.硫酸铜是重金属盐,能杀菌消毒.
解答 解:A.溶液和胶体都是分散系,属于混合物,故A错误;
B.因胶体能发生丁达尔效应,而溶液不能,故B错误;
C.因溶液中溶质粒子直径较小于1nm,胶体粒子直径在l~100nm之间,故C错误;
D.硫酸铜是重金属盐,能杀菌消毒,胶体具有较大的表面积,能用来净水,故D正确.
故选D.
点评 本题考查了胶体区别于其他分散系最本质的特征以及胶体的性质,要注意分散系的分类以分散质粒子直径在大小为依据,题目难度不大.

练习册系列答案
相关题目
2.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
3.反应 Fe(s)+CO2(g)?FeO(s)+CO(g)△H1 平衡常数为K1
Fe(s)+H2O (g)?FeO(s)+H2 (g)△H2 平衡常数为K2
在不同温度时K1、K2的值如表:
据此可知反应“CO2(g)+H2(g)?CO(g)+H2O(g)△H 平衡常数为K″的相关信息不正确的是( )
Fe(s)+H2O (g)?FeO(s)+H2 (g)△H2 平衡常数为K2
在不同温度时K1、K2的值如表:
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A. | △H=△H1-△H2 | |
| B. | K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 该反应进行时不断分离出H2O,可以提高CO2的转化率和反应速率 | |
| D. | 该反应正反应为吸热反应 |
20.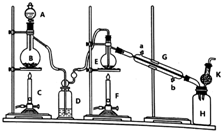 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
某同学设计的相关实验装置图如图:
(l)A中浓盐酸与B中物质进行反应,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中的试剂为浓硫酸,目的是除去H2O.
(3)G中冷却水的进水位置为b(填字母).
(4)为避免E中副反应的发生,对装置需要改进的措施是BD间增加盛饱和食盐水的洗气瓶.
(5)K中固体物质的作用为防止空气中水分进入.
(6)当要结束实验时,不能首先进行的操作是③.①关闭A的活塞 ②停止F的加热 ③停止G的通水.
(7)若将B中的固体换成Sn,并将除A和B以外的器皿去掉,反应可制备SnCl2.
(8)实验结束后,若得到的SnCl4为13.05g,至少消耗8.70g MnO2.为了避免尾气污染,需要改进的措施是在K后面加尾气吸收装置.
 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
(l)A中浓盐酸与B中物质进行反应,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中的试剂为浓硫酸,目的是除去H2O.
(3)G中冷却水的进水位置为b(填字母).
(4)为避免E中副反应的发生,对装置需要改进的措施是BD间增加盛饱和食盐水的洗气瓶.
(5)K中固体物质的作用为防止空气中水分进入.
(6)当要结束实验时,不能首先进行的操作是③.①关闭A的活塞 ②停止F的加热 ③停止G的通水.
(7)若将B中的固体换成Sn,并将除A和B以外的器皿去掉,反应可制备SnCl2.
(8)实验结束后,若得到的SnCl4为13.05g,至少消耗8.70g MnO2.为了避免尾气污染,需要改进的措施是在K后面加尾气吸收装置.
7.非金属性最强的元素是( )
| A. | C | B. | Si | C. | S | D. | Cl |
17.下列说法不正确的是( )
| A. | Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3 | |
| C. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| D. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 |
4.下列说法不正确的是( )
| A. | 石油的裂解可以提高汽油等轻质油的质量和产量 | |
| B. | 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 葡萄糖、淀粉、油脂在一定条件下都能发生水解反应 | |
| D. | 往蛋白质溶液中加入饱和硫酸铵溶液,产生的沉淀再加水又可溶解 |
1.可以用AG来表示溶液的酸度.AG与pH的关系如图:则下列说法正确的是( )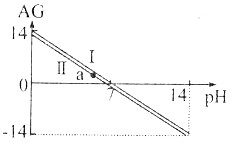

| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
19.化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是( )
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |