题目内容
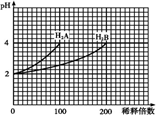 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )| A、H2A为二元强酸 |
| B、pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B) |
| D、Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:
分析:A.根据图象知,H2A溶液稀释100倍,溶液pH由2增至4,说明H2A是强酸;而H2B溶液稀释200倍,溶液PH增加2个单位,说明H2B为弱酸;
B.溶液中存在电离平衡:HA-=H++A2-,不存在H2A、HA-;
C.根据混合液中的物料守恒分析;
D.H2B是弱酸,其钠盐水溶液呈碱性,根据盐的水解原理判断溶液中离子浓度大小.
B.溶液中存在电离平衡:HA-=H++A2-,不存在H2A、HA-;
C.根据混合液中的物料守恒分析;
D.H2B是弱酸,其钠盐水溶液呈碱性,根据盐的水解原理判断溶液中离子浓度大小.
解答:
解:A.pH=2的H2A稀释100倍时溶液的pH变为4,说明该酸完全电离,所以为强酸,故A正确;
B.pH=4的NaHA水溶液中存在NaHA=Na++H++A2-、H2O?H++OH-,所以溶液呈存在粒子浓度大小顺序是c(H+)>c(Na+)=c(A2-)>c(OH-)>c(H2A),故B错误;
C.根据NaHA、NaHB的混合溶液中的物料守恒可得:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B),故C正确;
D.H2B为弱酸,所以Na2B的水溶液中,B2-两步电离生成氢氧根离子,但水解程度较小,钠离子不水解,导致溶液呈碱性,则溶液中离子浓度大小顺序是c(Na+)>c(B2-)>c(OH-)>c(HB-)>c(H+),故D正确;
故选B.
B.pH=4的NaHA水溶液中存在NaHA=Na++H++A2-、H2O?H++OH-,所以溶液呈存在粒子浓度大小顺序是c(H+)>c(Na+)=c(A2-)>c(OH-)>c(H2A),故B错误;
C.根据NaHA、NaHB的混合溶液中的物料守恒可得:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B),故C正确;
D.H2B为弱酸,所以Na2B的水溶液中,B2-两步电离生成氢氧根离子,但水解程度较小,钠离子不水解,导致溶液呈碱性,则溶液中离子浓度大小顺序是c(Na+)>c(B2-)>c(OH-)>c(HB-)>c(H+),故D正确;
故选B.
点评:本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,根据图象确定酸的强弱是解本题关键,再结合守恒思想分析解答,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
汽油燃料电池的一极通入空气,另一极通入汽油(以C2H6气体代表汽油);电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在较高温度下能传导O2-.下列对该燃料电池的说法不正确的是( )

| A、多孔电极a是燃料电池的负极 |
| B、生成的水从B口流出,汽油从C口流入 |
| C、在固体电解质中,O2-由正极移向负极 |
| D、通入汽油的一极是负极,电极反应为:C2H6+7O2--14e-═2CO2+3H2O |
某无色溶液中含有:①K+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥CO32-、⑦SO42-中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、可能含有的离子是①②⑦ |
| B、肯定含有的离子是①④ |
| C、不能确定的离子是①③⑦ |
| D、肯定没有的离子是②⑤⑥ |
下列液体中,滴入水中出现分层现象,滴入热的氢氧化钠溶液中分层现象不会逐渐消失的是(不考虑有机物的挥发)( )
| A、溴乙烷 | B、乙醛 |
| C、橄榄油 | D、汽油 |
下列物质加热熔化时破坏极性共价键的是( )
| A、干冰 | B、晶体硅 |
| C、氢氧化钠 | D、二氧化硅 |
下列说法正确的是( )
| A、除去MgCl2溶液中混有少量AlCl3,用氨水和盐酸 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、金属原子只有还原性,金属阳离子只有氧化性 |
| D、用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁 |
物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
| A、NH4Cl |
| B、NH4HCO3 |
| C、CH3COONH4 |
| D、NH4HSO4 |
下列关于化学用语的表示中,正确的是( )
A、次氯酸的电子式 |
| B、重水的分子式H218O |
| C、乙酸的结构式CH3COOH |
D、Mg2+的结构示意图 |