题目内容
物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
| A、NH4Cl |
| B、NH4HCO3 |
| C、CH3COONH4 |
| D、NH4HSO4 |
考点:影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:根据铵根离子的浓度和水解的影响角度来分析,如果含有对铵根离子水解起促进作用的离子,则铵根离子水解程度增大,如果含有抑制铵根离子水解的离子,则铵根的水解程度减弱.
解答:
解:物质的量浓度相同的下列溶液中不考虑(水解)其他因素影响,ABCD选项中铵根离子浓度分别比为1:1:1:1;
A、氯化铵中,铵根离子的水解不受氯离子的影响;
B、碳酸氢根离子对铵根离子的水解起到促进作用,导致铵根离子水解程度大,其铵根离子浓度较小;
C、醋酸根离子对铵根离子的水解起到促进作用,导致铵根离子水解程度大,其铵根离子浓度较小;
D、硫酸氢铵中的氢离子对铵根的水解起抑制作用,导致铵根离子水解程度较小,铵根离子浓度较大;
综上NH4+的浓度最大的是NH4HSO4.
故选D.
A、氯化铵中,铵根离子的水解不受氯离子的影响;
B、碳酸氢根离子对铵根离子的水解起到促进作用,导致铵根离子水解程度大,其铵根离子浓度较小;
C、醋酸根离子对铵根离子的水解起到促进作用,导致铵根离子水解程度大,其铵根离子浓度较小;
D、硫酸氢铵中的氢离子对铵根的水解起抑制作用,导致铵根离子水解程度较小,铵根离子浓度较大;
综上NH4+的浓度最大的是NH4HSO4.
故选D.
点评:本题考查学生离子的水解的影响因素、弱电解质的电离,注意把握影响盐的水解的因素,题目难度不大.

练习册系列答案
相关题目
已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法或表达正确的是( )
| A、在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | ||
B、H2(g)+
| ||
| C、氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | ||
| D、任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
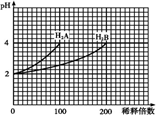 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )| A、H2A为二元强酸 |
| B、pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B) |
| D、Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+) |
室温下,将一元酸HA溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表下列判断正确的是( )
| 实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
| C(HA) | C(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中C(Na+)>C(A-)>C(OH-)>C(H+) | ||
B、实验①反应后的溶液中C(OH-)=C(Na+)-C(A-)=
| ||
| C、实验②反应后的溶液中C(A-)+C(HA)=0.1 mol/L | ||
| D、实验②反应后的溶液中C(Na+)=C(A-)>C(OH-)=C(H+) |
下列说法中,不正确的是( )
| A、CH4、NH3、H2O、三种分子的空间构型虽然不同,但中心原子的轨道杂化类型却相同 |
B、苯乙烯( )分子中的所有原子,不可能在同一平面内 )分子中的所有原子,不可能在同一平面内 |
| C、质谱仪可以测定有机化合物的相对分子质量 |
| D、红外光谱可以反映有机化合物中化学键或者官能团的相关信息 |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
| A、定容时俯视液面 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、未洗涤烧杯和玻璃棒 |
500mL 1mol/L的稀HCl与锌粒反应,不会使反应速率加快的是( )
| A、升高温度 |
| B、将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl |
| C、用1 mol/L的H2SO4代替1 mol/L的HCl |
| D、用锌粉代替锌粒 |
 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)═CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)═CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题: