题目内容
测定硫酸铜晶体(CuSO4?xH2O)结晶水含量的实验流程图如下:
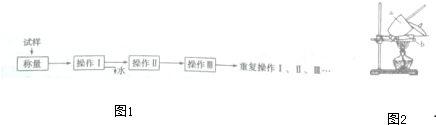
(1)“操作Ⅰ”是灼烧硫酸铜晶体,装置如有下图,写出装置中仪器的名称:a ,b
“操作Ⅰ”之前应将块状的硫酸铜晶体放在 中研碎.
(2)“操作Ⅱ”的操作是 ,必须在 中进行.
(3)判断硫酸铜晶体受热完全失去结晶水的依据是 (填字母)
a.加热时无水蒸气 b.胆矾晶体由蓝变白 c.固体质量不再减少 d.固体质量不断减少.

(1)“操作Ⅰ”是灼烧硫酸铜晶体,装置如有下图,写出装置中仪器的名称:a
“操作Ⅰ”之前应将块状的硫酸铜晶体放在
(2)“操作Ⅱ”的操作是
(3)判断硫酸铜晶体受热完全失去结晶水的依据是
a.加热时无水蒸气 b.胆矾晶体由蓝变白 c.固体质量不再减少 d.固体质量不断减少.
考点:硫酸铜晶体中结晶水含量的测定
专题:实验探究和数据处理题
分析:(1)依据实验室常见仪器回答即可;研碎固体应在研钵中进行;
(2)操作Ⅱ为冷却,应在干燥器中进行;
(3)硫酸铜晶体受热完全失去结晶水的依据是保持恒重,恒重是为确保硫酸铜晶体完全失去水.
(2)操作Ⅱ为冷却,应在干燥器中进行;
(3)硫酸铜晶体受热完全失去结晶水的依据是保持恒重,恒重是为确保硫酸铜晶体完全失去水.
解答:
解:(1)仪器a为坩埚,仪器b为泥三角,故答案为:坩埚;泥三角;研钵;
(2)测定CuSO4?xH2O中结晶水含量的实验操作包括加热、冷却、称量、恒重,为防止空气中的物质和其反应,所以应在干燥器中冷却,故答案为:冷却;干燥器;
(3)硫酸铜晶体受热完全失去结晶水的依据是保持恒重,故选c,故答案为:c.
(2)测定CuSO4?xH2O中结晶水含量的实验操作包括加热、冷却、称量、恒重,为防止空气中的物质和其反应,所以应在干燥器中冷却,故答案为:冷却;干燥器;
(3)硫酸铜晶体受热完全失去结晶水的依据是保持恒重,故选c,故答案为:c.
点评:本题考查了硫酸铜晶体中结晶水含量的测定,题目难度不大,注意掌握测定硫酸铜晶体结晶水含量的方法,明确实验过程中恒重称量的意义.

练习册系列答案
相关题目
设NA代表阿伏加德罗常数的值.下列说法错误的是( )
| A、30g甲醛(CH2O)与30g葡萄糖均含有NA个碳原子 |
| B、0.1molCl2与过量稀NaOH 溶液作用转移电子数0.2NA |
| C、常温下,1L pH=1的硫酸由水电离出的H+ 约为1×10-13NA |
| D、石墨电极电解CuSO4 溶液,阴极上有4mol电子转移,阳极上有NA个O2 |
自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A、AgNO3 |
| B、FeSO4 |
| C、MgCl2 |
| D、(NH4)2SO3 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol甲烷中含有10NA个质子 |
| B、27g铝被完全氧化成氧化铝,失去2NA个电子 |
| C、标准状况下,22.4 L苯含有NA个C6H6分子 |
| D、常温常压下,28g乙烯含有2NA个碳碳双键 |
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A、⑥、⑧、⑨对应原子的半径依次减小 |
| B、②、⑦的最高价氧化物对应的水化物能相互反应 |
| C、元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族 |
| D、①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
根据原子结构及元素周期律的知识,下列推断正确的是( )
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | ||||
| D、若M+和R2-的核外电子层结构相同,则原子序数R>M |
已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法或表达正确的是( )
| A、在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | ||
B、H2(g)+
| ||
| C、氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | ||
| D、任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
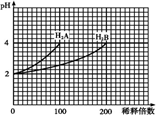 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )| A、H2A为二元强酸 |
| B、pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B) |
| D、Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+) |