题目内容
下列物质加热熔化时破坏极性共价键的是( )
| A、干冰 | B、晶体硅 |
| C、氢氧化钠 | D、二氧化硅 |
考点:化学键
专题:
分析:分子晶体熔化不破坏化学键,原子晶体熔化破坏共价键,离子晶体熔化破坏离子键;
同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,活泼金属和活泼非金属元素之间存在离子键.
同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,活泼金属和活泼非金属元素之间存在离子键.
解答:
解:A.干冰属于分子晶体,熔化时发生物理变化,破坏分子间作用力,故A错误;
B.晶体硅是原子晶体,硅原子和硅原子之间存在非极性共价键,所以硅熔化时破坏非极性共价键,故B错误;
C.氢氧化钠是离子晶体,钠离子和氢氧根离子之间存在离子键,所以氢氧化钠熔化时破坏离子键,故C错误;
D.二氧化硅是原子晶体,硅原子和氧原子之间存在极性共价键,二氧化硅熔化时破坏极性共价键,故D正确;
故选D.
B.晶体硅是原子晶体,硅原子和硅原子之间存在非极性共价键,所以硅熔化时破坏非极性共价键,故B错误;
C.氢氧化钠是离子晶体,钠离子和氢氧根离子之间存在离子键,所以氢氧化钠熔化时破坏离子键,故C错误;
D.二氧化硅是原子晶体,硅原子和氧原子之间存在极性共价键,二氧化硅熔化时破坏极性共价键,故D正确;
故选D.
点评:本题考查化学键断裂的条件,明确物质的类型与含有的化学键是解本题关键,注重基础知识的考查,难度中等.

练习册系列答案
相关题目
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A、⑥、⑧、⑨对应原子的半径依次减小 |
| B、②、⑦的最高价氧化物对应的水化物能相互反应 |
| C、元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族 |
| D、①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
下列元素一定为主族元素的是( )
| A、其原子最外电子层只1个电子的元素 |
| B、最低负化合价为-3价的元素 |
| C、其原子最外层电子数大于电子层数的元素 |
| D、最高价氧化物对应的水化物是酸的元素 |
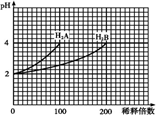 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )| A、H2A为二元强酸 |
| B、pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B) |
| D、Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+) |
下列事实得出的结论正确的是( )
| A、可用加热法除去氯化钠固体中的氯化铵杂质 |
| B、只用铜片不能鉴别浓硝酸和稀硝酸 |
| C、常温下,Al和浓硫酸钝化说明Al和浓硫酸在常温下不反应 |
| D、SO2通入氯化钡溶液无现象,若再通入NH3或NO2气体则都会产生BaSO4的白色沉淀 |
下列说法中,不正确的是( )
| A、CH4、NH3、H2O、三种分子的空间构型虽然不同,但中心原子的轨道杂化类型却相同 |
B、苯乙烯( )分子中的所有原子,不可能在同一平面内 )分子中的所有原子,不可能在同一平面内 |
| C、质谱仪可以测定有机化合物的相对分子质量 |
| D、红外光谱可以反映有机化合物中化学键或者官能团的相关信息 |
 .
.