题目内容
汽油燃料电池的一极通入空气,另一极通入汽油(以C2H6气体代表汽油);电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在较高温度下能传导O2-.下列对该燃料电池的说法不正确的是( )

| A、多孔电极a是燃料电池的负极 |
| B、生成的水从B口流出,汽油从C口流入 |
| C、在固体电解质中,O2-由正极移向负极 |
| D、通入汽油的一极是负极,电极反应为:C2H6+7O2--14e-═2CO2+3H2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、a是电子流入的一极,应是正极;
B、多孔电极b中汽油失电子发生氧化反应,氢离子与在该极的传导O2-,结合成水;
C、阴离子向负极移动;
D、电解质能在高温下能传导O2-,负极发生氧化反应,即1molC2H6失去电子生成CO2,共失去14mole-,6molH原子转化为3molH2O,根据质量守恒和电荷守恒写出电极反应为:C2H6+7O2--14e-═2CO2+3H2O.
B、多孔电极b中汽油失电子发生氧化反应,氢离子与在该极的传导O2-,结合成水;
C、阴离子向负极移动;
D、电解质能在高温下能传导O2-,负极发生氧化反应,即1molC2H6失去电子生成CO2,共失去14mole-,6molH原子转化为3molH2O,根据质量守恒和电荷守恒写出电极反应为:C2H6+7O2--14e-═2CO2+3H2O.
解答:
解:A、a是电子流入的一极,应是正极,故A错误;
B、多孔电极b中汽油失电子发生氧化反应,氢离子与在该极的传导O2-,结合成水,所以生成的水从B口流出,汽油从C口流入,故B正确;
C、阴离子向负极移动,所以O2-由正极移向负极,故C正确;
D、电解质能在高温下能传导O2-,负极发生氧化反应,即1molC2H6失去电子生成CO2,共失去14mole-,6molH原子转化为3molH2O,根据质量守恒和电荷守恒写出电极反应为:C2H6+7O2--14e-═2CO2+3H2O,故D正确;
故选A.
B、多孔电极b中汽油失电子发生氧化反应,氢离子与在该极的传导O2-,结合成水,所以生成的水从B口流出,汽油从C口流入,故B正确;
C、阴离子向负极移动,所以O2-由正极移向负极,故C正确;
D、电解质能在高温下能传导O2-,负极发生氧化反应,即1molC2H6失去电子生成CO2,共失去14mole-,6molH原子转化为3molH2O,根据质量守恒和电荷守恒写出电极反应为:C2H6+7O2--14e-═2CO2+3H2O,故D正确;
故选A.
点评:本题考查了燃料电池的工作原理以及电极反应式的书写等知识,属于综合知识的考查,难度中等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A、AgNO3 |
| B、FeSO4 |
| C、MgCl2 |
| D、(NH4)2SO3 |
根据原子结构及元素周期律的知识,下列推断正确的是( )
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | ||||
| D、若M+和R2-的核外电子层结构相同,则原子序数R>M |
已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法或表达正确的是( )
| A、在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | ||
B、H2(g)+
| ||
| C、氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | ||
| D、任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
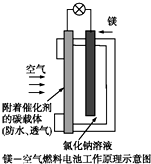 镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )
镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )| A、该电池Mg作负极,发生还原反应 |
| B、该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| C、电池工作时,电子通过导线由碳电极流向Mg电极 |
| D、当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
下列说法中正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、需要加热的化学反应,生成物的总能量一定高于反应物的总能量 |
| C、熵减的反应一定是非自发反应 |
| D、己知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
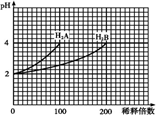 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是( )| A、H2A为二元强酸 |
| B、pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B) |
| D、Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+) |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
| A、定容时俯视液面 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、未洗涤烧杯和玻璃棒 |