题目内容
3.食盐是日常生活的必需品,也是重要的化工原料.(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
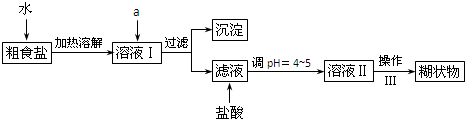
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3(只填化学式).
②加盐酸的目的是(用离子方程式表示)H++OH-=H2O2H++CO32-=CO2↑+H2O.
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.
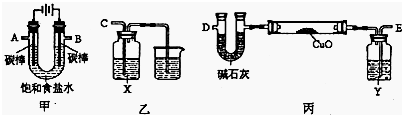
①乙装置中X试剂可以是NaBr的CCl4溶液,现象是溶液分层,下层是橙红色溶液.
②为完成上述实验,正确的连接顺序为A连E,B连CC(填接口字母).
③丙装置中Y试剂的作用是干燥H2,丙中碱石灰的作用是吸收CuO、H2反应生成的水.
④测定Cu的相对原子质量.
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量.
| 方案 质量 | 方案一 | 方案二 |
| U型管+固体 | 硬质玻璃管+固体 | |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
偏低(填“偏低”、“偏高”).按较佳方案计算,得到Cu的相对原子质量是$\frac{16(d+w-c)}{c-d}$.
分析 (1)根据镁离子和铁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(2)①②电解饱和食盐水,Cl-在阳极失电子产生氯气,H+在阴极得电子产生氢气,H+不断得到电子,结果溶液里OH-的数目相对地增多了,因而阴极附近形成了氢氧化钠的溶液.A为阴极,产生的氢气通入E试剂中干燥,再通入CuO粉末来测定Cu的相对原子质量;B为阳极,产生的氯气通入X试剂验证氯气的氧化性;
③丙装置中Y试剂是为了吸收氢气中的水,减少误差;U型管吸收产生的水;
④选方案一的数据进行计算时,主要考虑U型管也可能吸收空气中的水和CO2会导致测定Cu的相对原子质量偏大或偏小;选用方案二数据进行计算是利用反应前后CuO中氧元素的减少量和实验前准确称取CuO的质量为wg中氧元素的质量相等,求得Cu的相对原子质量.
解答 解:(1)①加入过量的氢氧化钠可以除去镁离子和铁离子,加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠,加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡,加入氯化钡可以除去硫酸根离子,欲除去Ca2+、Mg2+、Fe3+、SO42-离子,先加入过量BaCl2溶液,与SO42-发生反应,生成BaSO4沉淀;再加过量NaOH溶液,与Mg2+和Fe3+发生反应,生成Mg(OH)2沉淀、Fe(OH)3沉淀,最后加入过量Na2CO3溶液,与Ca2+发生反应,生成CaCO3沉淀,与过量BaCl2的反应生成生成BaCO3沉淀;所以滴加的顺序为:BaCl2,NaOH,Na2CO3;
故答案为:BaCl2溶液,NaOH溶液,Na2CO3溶液;
②加适量盐酸,与①中过量NaOH溶液和过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑;
故答案为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑;
(2)①电解饱和食盐水产生的氯气与NaBr反应得到氯化钠和溴单质,溴在CCl4中易溶,且CCl4密度比水大,与水不互溶,所以溶液分层,下层是橙红色溶液.
故答案为:溶液分层,下层是橙红色溶液;
②A为阴极,产生的氢气中含有水蒸气,通入Y试剂中进行干燥,再通入CuO粉末来测定Cu的相对原子质量,减少误差;B为阳极,产生的氯气通入X试剂中验证氯气的氧化性;所以A连E,B连C;
故答案为:E,C;
③电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,需进行干燥,丙装置中Y试剂是为了吸收氢气中的水;U型管吸收产生的水.
故答案为:干燥H2 吸收CuO、H2反应生成的水;
④如选方案一数据进行计算时,U形管中的干燥剂也可能吸收空气中的水和CO2,导致测定结果偏大,得到Cu的相对原子质量偏低;
根据质量守恒定律和题给氧化铜质量及方案二所测数据,
设Cu的相对原子质量为x,由反应前后氧元素的质量是不变的,w×$\frac{16}{16+x}$=c-d 解得:x=$\frac{16(d+w-c)}{c-d}$
故答案为:$\frac{16(d+w-c)}{c-d}$.
点评 本题涉及粗盐的提纯、电解池的工作原理等方面的知识,属于综合知识的考查,除杂时,注意除杂的最后不能再有其他杂质,过滤要放在所有沉淀步骤的最后;利用实验测定数据进行计算,要排出诸多影响测定结果的干扰,此题真能锻炼学生应用所学知识及慎密思维的能力.

 阅读快车系列答案
阅读快车系列答案(1)某温度下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0 mol O2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件
(以V2O5作催化剂)温度450℃;压强1×105Pa,选择此压强的理由再增压转化率增大不明显,加大成本
| 1×l05 Pa | 5×l05 Pa | 10×l05 Pa | 50×l05 Pa | 100×l05 Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变 C.混合气体中SO3的浓度不变
D.c(SO2)=c(SO3) E.v正(SO2)=v 正(SO3) F.v正(SO3)=2v逆(O2)
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | 标准状况下,11.2L N2和O2混合气体中所含分子数为0.5NA | |
| B. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| C. | 常温常压下,20g ND3中所含质子数为10NA | |
| D. | 向含0.2mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为NA |
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱 | |
| B. | 在MgCl2 与AlCl3 溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 | |
| C. | 硫酸和硅酸钠溶液反应产生白色沉淀,判断硫与硅的非金属活动性强弱 | |
| D. | Br2 与I2 分别与足量的H2 反应,判断溴与碘的非金属活动性强弱 |
| A. | 稀氨水和Al2(SO4)3 | B. | 稀盐酸和Na2CO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
| A. | sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 | |
| B. | 乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键 | |
| C. | 凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形 | |
| D. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 |
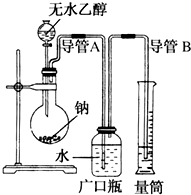 为了确定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目.试回答下列问题:
为了确定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目.试回答下列问题: