题目内容
5.实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,其实验过程如图:
下列说法正确的是( )
| A. | 操作a的名称为蒸馏 | |
| B. | 反应I、II中碘元素均被氧化 | |
| C. | 还原性强弱顺序:SO32->I->Cl- | |
| D. | 若反应I消耗25.2g Na2SO3,则反应II消耗标准状况下氯气的体积为4.48L |
分析 由实验流程可知,含碘废液与亚硫酸钠发生SO32-+I2+H2O=2I-+2H++SO42-,反应后与CCl4分层,分液可分离出CCl4,再通入氯气发生Cl2+2I-=I2+2Cl-,富集、萃取、分液、蒸馏可得到碘,以此来解答.
解答 解:A.由上述分析可知,操作a为分液,故A错误;
B.I中I元素的化合价降低被还原,II中碘元素化合价升高被氧化,故B错误;
C.由SO32-+I2+H2O=2I-+2H++SO42-、Cl2+2I-=I2+2Cl-,还原剂的还原性大于还原产物的还原性,则还原性强弱顺序为SO32->I->Cl-,故C正确;
D.由SO32-~Cl2,若反应I消耗25.2g Na2SO3,理论上则反应II消耗标准状况下氯气的体积为$\frac{25.2g}{126g/mol}$×22.4L/mol=4.48L,而含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I-,这样做的目的是使CCl4中的碘进入水层,从而与CCl4分层,便于分离,则实际上消耗氯气小于4.48L,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握分离流程中的反应、混合物分离方法等为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应、分液法应用等,选项D为解答的难点和易错点,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
15.下列化学用语的表述错误的是( )
| A. | 18O2-离子的结构示意图: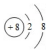 | |
| B. | 甲烷分子的比例模型: | |
| C. | 二氧化碳分子的电子式: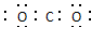 | |
| D. | 氮原子核外电子排布的轨道表示式: |
13.A、B、C、D四种物质之间的转化关系如图所示(部分产物略去),下列说法正确的是( )
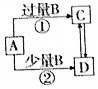

| A. | 若A为AlCl3溶液,B 可能为氨水,反应①的离子方程式为Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 若A为Fe,B可能为稀HNO3,反应②的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴定C、D 溶液中的阴离子 | |
| D. | 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3 |
20.下列说法正确的是( )
| A. | SO2、NO2、CO均为酸性氧化物 | |
| B. | 水玻璃、明矾、漂白粉都是强电解质 | |
| C. | 煤油、“乙醇汽油”“生物柴油”都是碳氢化合物 | |
| D. | 纳米铁粉去除水体中的Hg2+和植物油酸败都是发生了氧化还原反应 |
6.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
| A. | 7.5 L | B. | 12.3 L | C. | 15.7 L | D. | 16.8 L |
3.下列无色气体中,遇空气变成红棕色的是( )
| A. | CO | B. | HCl | C. | SO2 | D. | NO |
4.同温同压下,甲乙两容器分别装有CH4和NH3气体,已知它们所含原子数相同,则甲乙两容器体积比为( )
| A. | 4:3 | B. | 4:5 | C. | 5:4 | D. | 1:1 |
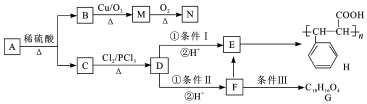
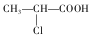 +HCl
+HCl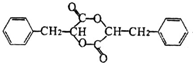 .
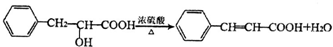
.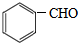 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$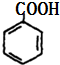 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.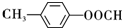 .
. .
.