题目内容
10.在200mL0.2mol/L的硫酸侗溶液中浸入质量为10g的铁片,反应片刻后取出铁片,经洗涤干燥,称得质量为10.6g,求反应后溶液中硫酸铜物质的量浓度(设溶液体积保持不变).分析 发生反应:Fe+CuSO4═FeSO4+Cu,利用差量法来计算参加反应的CuSO4的物质的量,进而计算反应后溶液中CuSO4的物质的量浓度.
解答 解:设参加反应的CuSO4的物质的量为xmol,则:
Fe+CuSO4 ═FeSO4 +Cu 质量增重△m
1mol 64g-56g=8g
xmol 10.6g-10g=0.6g
所以1mol:xmol=8g:0.6g
解得x=0.075mol
反应后剩余硫酸铜:0.2L×0.2mol/L-0.075mol=0.035mol,其浓度为:$\frac{0.035mol}{0.2L}$=0.175mol/L,
答:反应后溶液后溶液中硫酸铜物质的量浓度为0.175mol/L.
点评 本题考查化学反应方程式的计算,难度不大,注意对差量法的理解应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列物质用加热的方法可分离的是( )
| A. | 氯化铵和消石灰固体 | B. | 碳酸氢铵和过氧化钠固体 | ||
| C. | 碘化钾和碘晶体 | D. | 硝酸钾与食盐晶体 |
1.下列有关材料的说法错误的是( )
| A. | 铁制品在潮湿空气中更易锈蚀 | |
| B. | 二氧化硅常用于制造光导纤维 | |
| C. | 实验室中经过滤可得到纳米碳酸钙固体 | |
| D. | 聚乙烯可作食品包装材料 |
18.下列反应中,H2SO4只作氧化剂的是( )
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | 2SO2+O2+2H2O═2H2SO4 | ||
| C. | Cu+2H2SO4$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | D. | C+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2SO2↑+CO2↑+2H2O |
5.实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,其实验过程如图:
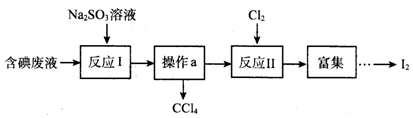
下列说法正确的是( )

下列说法正确的是( )
| A. | 操作a的名称为蒸馏 | |
| B. | 反应I、II中碘元素均被氧化 | |
| C. | 还原性强弱顺序:SO32->I->Cl- | |
| D. | 若反应I消耗25.2g Na2SO3,则反应II消耗标准状况下氯气的体积为4.48L |
8.下列物质分解后不菌固体残渣的是( )
| A. | NaHCO3 | B. | CaCO3 | C. | NH4Cl | D. | Cu(NO3)2 |
9.在盛有溴水的试管中,加入少量苯后振荡,静置后( )
| A. | 整个溶液变橙色 | B. | 整个溶液变浅棕色 | ||
| C. | 上层无色、下层橙色 | D. | 下层无色、上层橙色 |