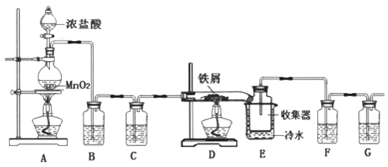
题目内容
15.下列化学用语的表述错误的是( )| A. | 18O2-离子的结构示意图: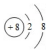 | |
| B. | 甲烷分子的比例模型: | |
| C. | 二氧化碳分子的电子式: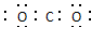 | |
| D. | 氮原子核外电子排布的轨道表示式: |
分析 A.O2-离子核外有2个电子层,最外层电子数为8;
B.甲烷分子中H原子比C原子小;
C.二氧化碳中含有C=O键;
D.氮原子核外有2个电子层,最外层电子数为5.
解答 解:A.O2-离子核外有2个电子层,最外层电子数为8,则结构示意图: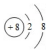 ,故A正确;
,故A正确;
B.甲烷分子中H原子比C原子小,则比例模型: ,故B正确;
,故B正确;
C.二氧化碳中含有C=O键,电子式为 ,故C错误;
,故C错误;
D.氮原子核外有2个电子层,最外层电子数为5,核外电子排布的轨道表示式为 ,故D正确.
,故D正确.
故选C.
点评 本题考查常用化学用语的书写,为高频考点,侧重考查学生的双基的掌握,题目难度不大,掌握常用化学用语的书写,注意二氧化碳的电子式书写,分子中存在两个碳氧双键,为易错点.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,28gCO和C2H4混合气体中的碳原子数为NA | |
| B. | 1molN2与3molH2充分反应,产物的分子数为2NA | |
| C. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| D. | 32g硫粉与足量的Cu粉完全反应,转移的电子数为2NA |
10.下列实验操作和理象、结论均正确且有因果关系的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色 | 原溶液中含有I- |
| B | 常温下,0.1mol/LNaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| C | 相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH | 亚硫酸的酸性强于碳酸 |
| D | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色 | 稀HNO3将Fe氧化为Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
20.下列物质用加热的方法可分离的是( )
| A. | 氯化铵和消石灰固体 | B. | 碳酸氢铵和过氧化钠固体 | ||
| C. | 碘化钾和碘晶体 | D. | 硝酸钾与食盐晶体 |
7.下列化学反应所对应的离子方程式书写正确的是( )
| A. | 醋酸铵与稀盐酸反应:CH3COONH4+H+→CH3COOH+NH4+ | |
| B. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-→2Fe2++S↓ | |
| C. | 硫酸铜溶液中加入过量的氢氧化钡:Ba2++SO42-→BaSO4↓ | |
| D. | 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-→6Cl-+2Fe3++2Br2 |
4.用NA表示阿伏加德罗常数的数值.下列叙述正确的是( )
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 含4.9 g H2SO4与4.9 g H3PO4的混合溶液中氧原子数为0.4NA | |
| C. | 常温下,0.1 mol C2H4分子中含共用电子对数目为0.6NA | |
| D. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA |
5.实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,其实验过程如图:
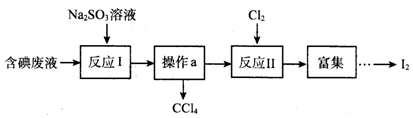
下列说法正确的是( )

下列说法正确的是( )
| A. | 操作a的名称为蒸馏 | |
| B. | 反应I、II中碘元素均被氧化 | |
| C. | 还原性强弱顺序:SO32->I->Cl- | |
| D. | 若反应I消耗25.2g Na2SO3,则反应II消耗标准状况下氯气的体积为4.48L |