题目内容
6.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )| A. | 7.5 L | B. | 12.3 L | C. | 15.7 L | D. | 16.8 L |
分析 利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=$\frac{m}{M}$计算n(CuO),根据电子转移守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO)、n(NO2),根据V=nVm计算气体体积,实际气体介于二者之间.
解答 解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)=$\frac{12g}{80g/mol}$=0.15mol,转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO的物质的量为x、NO2的物质的量为x,则3x+x=1.2,解得x=0.3,故气体体积V=0.6mol×22.4L/mol=13.44L;
若混合物全是Cu2S,其物质的量n(Cu2S)=$\frac{1}{2}$n(CuO)=$\frac{1}{2}$×0.15mol=0.075mol,转移电子物质的量0.075×10=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,解得x=0.1875,气体体积0.1875mol×2×22.4L/mol=8.4L,
故8.4L<V<13.44L,只有B符合,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握极限法及电子守恒为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
7.下列化学反应所对应的离子方程式书写正确的是( )
| A. | 醋酸铵与稀盐酸反应:CH3COONH4+H+→CH3COOH+NH4+ | |
| B. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-→2Fe2++S↓ | |
| C. | 硫酸铜溶液中加入过量的氢氧化钡:Ba2++SO42-→BaSO4↓ | |
| D. | 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-→6Cl-+2Fe3++2Br2 |
5.实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,其实验过程如图:
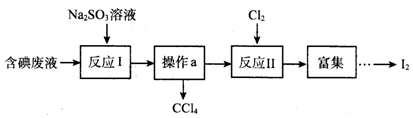
下列说法正确的是( )

下列说法正确的是( )
| A. | 操作a的名称为蒸馏 | |
| B. | 反应I、II中碘元素均被氧化 | |
| C. | 还原性强弱顺序:SO32->I->Cl- | |
| D. | 若反应I消耗25.2g Na2SO3,则反应II消耗标准状况下氯气的体积为4.48L |
1.将38.4g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为( )
(已知:2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O)
(已知:2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O)
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.4 mol | D. | 0.2mol |
18.将5gAl、Al2O3、Al(OH)3的混合物与200g4.9%的稀硫酸混合,恰好完全反应.将反应后的溶液蒸干后,最终得到固体的质量是( )
| A. | 11.4g | B. | 14.8g | C. | 205g | D. | 无法计算 |
15.下列反应进行分类时,既属于氧化还原反应又属于置换反应的是( )
| A. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$Fe+4CO2 | B. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |