题目内容
20.下列说法正确的是( )| A. | SO2、NO2、CO均为酸性氧化物 | |
| B. | 水玻璃、明矾、漂白粉都是强电解质 | |
| C. | 煤油、“乙醇汽油”“生物柴油”都是碳氢化合物 | |
| D. | 纳米铁粉去除水体中的Hg2+和植物油酸败都是发生了氧化还原反应 |
分析 A.和碱反应生成盐和水的氧化物为酸性氧化物;
B.水溶液中或熔融状态下导电的化合物为电解质,在溶液中完全电离的电解质属于强电解质;
C.乙醇汽油中含有醇,生物柴油成分为酯类;
D.存在元素化合价变化的反应属于氧化还原反应.
解答 解:A.和碱反应生成盐和水的氧化物为酸性氧化物,SO2为酸性氧化物,NO2、CO不是酸性氧化物,故A错误;
B.水玻璃、漂白粉是混合物不是电解质,明矾是强电解质;
C.煤油的成分是碳氢化合物,“乙醇汽油”中含有乙醇,乙醇中含有C、H、O三种元素,生物柴油成分为酯类不是碳氢化合物,故C错误;
D.纳米铁粉去除水体中的Hg2+,Fe和Hg的化合价发生变化,是氧化还原反应,植物油酸败也是发生了氧化还原反应,故D正确.
故选D.
点评 本题考查了强电解质和电解质、酸性氧化物等概念、以及有机物的组成,题目难度不大,注意这几个概念的区别,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
10.下列实验操作和理象、结论均正确且有因果关系的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色 | 原溶液中含有I- |
| B | 常温下,0.1mol/LNaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| C | 相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH | 亚硫酸的酸性强于碳酸 |
| D | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色 | 稀HNO3将Fe氧化为Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
11.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 100mL12Lmol•L-1浓盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 1mol•L-1的NaClO溶液中含有ClO-的数目为小于NA | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| D. | O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA |
15.下列物质转化在给定条件下能实现转化的是( )
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | Fe2O3$\stackrel{稀盐酸}{→}$FeCl3$\stackrel{蒸发,灼烧}{→}$无水FeCl3 | |
| C. | 纤维素$→_{△}^{浓硫酸}$葡萄糖$→_{酶}^{O_{2}}$CO2+H2O | |
| D. | 饱和NaCl溶液$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
5.实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,其实验过程如图:
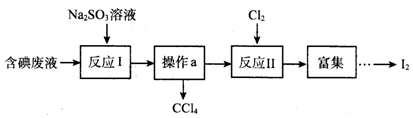
下列说法正确的是( )

下列说法正确的是( )
| A. | 操作a的名称为蒸馏 | |
| B. | 反应I、II中碘元素均被氧化 | |
| C. | 还原性强弱顺序:SO32->I->Cl- | |
| D. | 若反应I消耗25.2g Na2SO3,则反应II消耗标准状况下氯气的体积为4.48L |
1.将38.4g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为( )
(已知:2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O)
(已知:2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O)
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.4 mol | D. | 0.2mol |
18.将5gAl、Al2O3、Al(OH)3的混合物与200g4.9%的稀硫酸混合,恰好完全反应.将反应后的溶液蒸干后,最终得到固体的质量是( )
| A. | 11.4g | B. | 14.8g | C. | 205g | D. | 无法计算 |
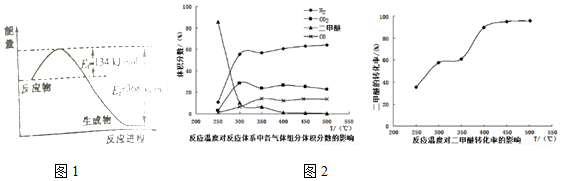
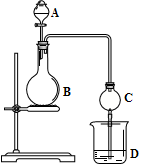 化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热).
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热).