题目内容
4.下列说法正确的是( )| A. | 常温常压下,22.4L氮气所含原子数目大于2NA | |
| B. | 1 mol Na2O2跟H2O反应转移的电子数目为2NA | |
| C. | 标准状态下,22.4L三氧化硫所含分子数目大于NA | |
| D. | 1 mol甲烷的质量与0.5 mol O2的质量不相等 |
分析 A.气体摩尔体积是指标准状况下1mol气体所占体积为22.4L,常温常压下气体摩尔体积增大,22.4L氮气物质的量小于1mol;
B.过氧化钠和水的反应为2Na2O2+2H2O=4NaOH+O2,氧元素化合价从-1价变化为0价和-2价,根据过氧化钠和转移电子之间的关系式计算;
C.气体摩尔体积是指标准状况下1mol气体所占体积为22.4L,三氧化硫标准状况不是气体;
D.依据m=nM计算,1 mol甲烷的质量=1mol×16g/mol=16g,0.5 mol O2的质量=0.5mol×32g/mol=16g;
解答 解:A.常温常压下气体摩尔体积增大,22.4L氮气物质的量小于1mol,所含原子数目小于2NA ,故A错误;
B.1 mol Na2O2和水的反应为2Na2O2+2H2O=4NaOH+O2,氧元素化合价从-1价变化为0价和-2价,转移电子数目=1mol[0-(-1)]=1mol,转移电子数为NA,故B错误;
C.标准状态下,三氧化硫不是气体,密度大于1g/ml,22.4L三氧化硫质量大于80g,物质的量大于1mol,标准状态下,22.4L三氧化硫所含分子数目大于NA,故C正确;
D.1 mol甲烷的质量=1mol×16g/mol=16g,0.5 mol O2的质量=0.5mol×32g/mol=16g,1 mol甲烷的质量与0.5 mol O2的质量相等,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积应用条件判断,氧化还原反应电子转移计算,气体摩尔体积的条件应用是易错点,题目难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
14.下列说法不正确的是( )
| A. | 1mol 氧气的质量为32g | |
| B. | 常温常压下,1mol CO2气体体积约为22.4L | |
| C. | CO2的摩尔质量为44g/mol | |
| D. | 1L 2mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
15.某温度下,恒压容器中发生N2(g)+3H2(g)?2NH3(g)达到平衡时容器体积为1L,三种组成按方程式书写顺序依次为1mol、3mol、2mol,若此时再向容器中再充入54mol N2平衡将( )
| A. | 正向移动 | B. | 逆向移动 | ||
| C. | 不移动 | D. | 无法确定移动方向 |
12.下列物质变化过程中生成了强酸的是( )
| A. | CO2通入水中 | B. | SO3通入水中 | ||
| C. | 钠粒投入水中 | D. | 硫酸铜溶液中滴加氨水 |
19.将含有0.400mol CuSO4和0.200mol FeCl3水溶液1L,用惰性电极电解一段时间后在电极上析出19.2g Cu,此时在另一电极上放出的气体在标状况下的体积为( )
| A. | 5.60L | B. | 6.72L | C. | 4.48L | D. | 7.84L |
16.下列反应属于取代反应的是( )
| A. | 乙烯通入酸性KMnO4溶液中,溶液的紫色褪去 | |
| B. | 乙烯与乙醇在浓硫酸作用下共热反应生成乙酸乙酯 | |
| C. | 苯与溴水混合振荡,溴水层的颜色变浅 | |
| D. | 苯与氢气在一定条件下反应生成环已烷 |
13.不能同时满足在溶液和非溶液状态下发生置换反应的是( )
| A. | 金属单质置换金属单质 | B. | 金属单质置换非金属单质 | ||
| C. | 非金属单质置换金属单质 | D. | 非金属单质置换非金属单质 |
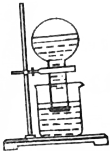 甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.
甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.