题目内容
12.下列物质变化过程中生成了强酸的是( )| A. | CO2通入水中 | B. | SO3通入水中 | ||
| C. | 钠粒投入水中 | D. | 硫酸铜溶液中滴加氨水 |
分析 A.二氧化碳与水反应生成碳酸;
B.三氧化硫与水反应生成硫酸;
C.钠与水反应生成氢氧化钠和氢气;
D.硫酸铜与氨水反应生成氢氧化铜沉淀和硫酸铵.
解答 解:A.二氧化碳与水反应生成碳酸,碳酸为弱酸,故A错误;
B.三氧化硫与水反应生成硫酸,硫酸为强酸,符合题意,故B正确;
C.钠与水反应生成氢氧化钠和氢气,氢氧化钠为强碱,故C错误;
D.硫酸铜与氨水反应生成氢氧化铜沉淀和硫酸铵,氢氧化铜为弱碱,故D错误;
故选:B.
点评 本题考查了物质的反应及性质,熟悉相关物质的性质及发生反应是解题关键,题目难度不大.

练习册系列答案
相关题目
2.将0.05mol铜投入到足量的下列溶液中,溶液质量增加的是( )
| A. | 硫酸亚铁溶液 | B. | 氯化铝溶液 | C. | 硝酸银溶液 | D. | 氯化铁溶液 |
3.下列说法中正确的是( )
| A. | 二氧化硫溶于水能导电,故二氧化硫属于电解质 | |
| B. | 硫酸钡难溶于水,故硫酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
20.化学与生活息息相关,下列说法正确的是( )
| A. | 下列生活用品主要由有机合成材料制成:羊毛衫、腈纶运动衣、涤纶连衣裙、纯棉T恤 | |
| B. | 不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,所以不锈钢是化合物 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
17.已知SO2+H2O2═H2SO4.将贮满干燥的某种气体的试管倒置于某种液体(括号内物质为液体,且液体足量)中,轻轻震荡,液体可以充满试管.该气体不可能是( )
| A. | HCl(澄清石灰水) | B. | NO2(H2O) | C. | SO2(H2O2溶液) | D. | Cl2(NaOH溶液) |
4.下列说法正确的是( )
| A. | 常温常压下,22.4L氮气所含原子数目大于2NA | |
| B. | 1 mol Na2O2跟H2O反应转移的电子数目为2NA | |
| C. | 标准状态下,22.4L三氧化硫所含分子数目大于NA | |
| D. | 1 mol甲烷的质量与0.5 mol O2的质量不相等 |
1.某盐溶液滴入氯水无明显现象,在滴入硝酸酸化的硝酸钡,有白色沉淀生成,则某盐可能是( )
| A. | MgCl2 | B. | FeSO4 | C. | Na2SO3 | D. | ZnSO4 |
8.一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD.
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd.
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
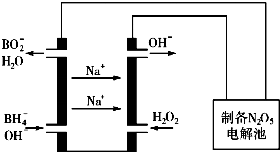
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD.
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd.
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
