题目内容
14.下列说法不正确的是( )| A. | 1mol 氧气的质量为32g | |
| B. | 常温常压下,1mol CO2气体体积约为22.4L | |
| C. | CO2的摩尔质量为44g/mol | |
| D. | 1L 2mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
分析 A.氧气摩尔质量为32g/mol,则1mol 氧气的质量为32g;
B.常温常压下气体摩尔体积等于22.4L/mol;
C.摩尔质量以g/mol为单位,数值等于其相对分子质量;
D.氯离子浓度为氯化钡的2倍,根据n=cV计算氯离子物质的量,再根据N=nNA计算氯离子数目.
解答 解:A.氧气摩尔质量为32g/mol,则1mol 氧气的质量为32g,故A正确;
B.常温常压下气体摩尔体积等于22.4L/mol,常温常压下,1mol CO2气体体积大于22.4L,故B错误;
C.二氧化碳相对分子质量为44,则其摩尔质量为44g/mol,故C正确;
D.氯离子浓度为氯化钡的2倍,氯离子物质的量为1L×2×2mol/L=4mol,溶液中氯离子数目为4mol×6.02×1023mol-1=2.408×1024,故D正确,
故选:B.
点评 本题考查摩尔质量、气体摩尔体积、物质的量有关计算,难度不大,注意气体摩尔体积的使用条件与对象,根据PV=nRT理解温度、压强对气体摩尔体积的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.1g火箭燃料N2H4燃烧,生成N2和H2O(g),同时放出16.7kJ的热量,表示该反应的热化学方程式正确的是( )
| A. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-1 | |
| B. | N2H4+O2═N2+2H2O△H=-1 068.8 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1 | |
| D. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267.2 kJ•mol-1 |
5.工业上回收利用某合金废料(主要含Fe、Cu、Al、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
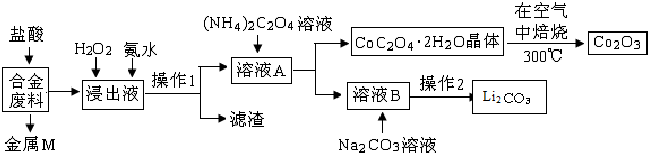
已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19.pH=7.3时Li+或Co3+开始沉淀.
(1)金属M为Cu.
(2)①加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O.
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol•L-1).需调节溶液pH范围为5.0<pH<7.3.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失.
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+CO2↑.
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a).电池反应为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2,
写出该电池放电时的负极反应式LixC6-xe-=C6+xLi+.
②锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极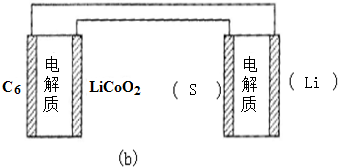 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.
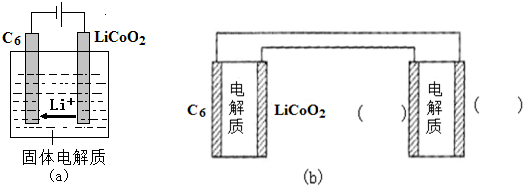

已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19.pH=7.3时Li+或Co3+开始沉淀.
(1)金属M为Cu.
(2)①加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O.
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol•L-1).需调节溶液pH范围为5.0<pH<7.3.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a).电池反应为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2,
写出该电池放电时的负极反应式LixC6-xe-=C6+xLi+.
②锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极
 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.
2.将0.05mol铜投入到足量的下列溶液中,溶液质量增加的是( )
| A. | 硫酸亚铁溶液 | B. | 氯化铝溶液 | C. | 硝酸银溶液 | D. | 氯化铁溶液 |
9.NaClO2可用作造纸的漂白剂,它由:H2O2+2ClO2+2NaOH═2NaClO2+2H2O+O2制得,下列说法正确的是( )
| A. | H2O2是氧化剂,H2O2中的氧元素被还原 | |
| B. | 每生成1 mol O2转移的电子的物质的量为2 mol | |
| C. | ClO2中的氯元素被氧化 | |
| D. | ClO2是氧化剂,H2O2是还原剂 |
19.下列解释物质用途或现象的反应方程式不准确的是( )
| A. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO-3+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液;2Fe3++2I-═2Fe2++I2 | |
| C. | Na2S203溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H2O |
6.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 开始蒸馏时,应该先通冷凝水,再加热;蒸馏完毕,应该先撤酒精灯再停通冷凝水 | |
| C. | 使用托盘天平称量物质时,先取小砝码,再依次取较大的砝码 | |
| D. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
3.下列说法中正确的是( )
| A. | 二氧化硫溶于水能导电,故二氧化硫属于电解质 | |
| B. | 硫酸钡难溶于水,故硫酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
4.下列说法正确的是( )
| A. | 常温常压下,22.4L氮气所含原子数目大于2NA | |
| B. | 1 mol Na2O2跟H2O反应转移的电子数目为2NA | |
| C. | 标准状态下,22.4L三氧化硫所含分子数目大于NA | |
| D. | 1 mol甲烷的质量与0.5 mol O2的质量不相等 |