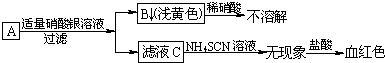
题目内容
13.不能同时满足在溶液和非溶液状态下发生置换反应的是( )| A. | 金属单质置换金属单质 | B. | 金属单质置换非金属单质 | ||
| C. | 非金属单质置换金属单质 | D. | 非金属单质置换非金属单质 |
分析 A.铁与硫酸铜溶液发生置换反应生成铜和硫酸亚铁;铝与氧化铁发生置换反应生成铁和氧化铝;
B.铁与盐酸溶液反应生成氯化亚铁和氢气;镁与二氧化碳反应生成氧化镁和碳;
C.非金属单质置换金属单质在溶液不能发生;氢气能够与氧化铜反应生成铜和水;
D.氯气与碘化钾生成单质碘和氯化钾;碳与二氧化硅反应生成硅与一氧化碳.
解答 解:A.铁与硫酸铜溶液发生置换反应生成铜和硫酸亚铁;铝与氧化铁发生置换反应生成铁和氧化铝,在溶液和非溶液状态下都能发生置换反应,故A不选;
B.铁与盐酸溶液反应生成氯化亚铁和氢气;镁与二氧化碳反应生成氧化镁和碳,在溶液和非溶液状态下都能发生置换反应,故B不选;
C.氢气能够与氧化铜反应生成铜和水,非金属单质置换金属单质在溶液不能发生置换反应,故C选;
D.氯气与碘化钾生成单质碘和氯化钾;碳与二氧化硅反应生成硅与一氧化碳,在溶液和非溶液状态下都能发生置换反应,故D不选;
故选C.
点评 本题考查了常见反应类型置换反应,明确置换反应的定义,熟悉常见的置换反应是解题关键,注意对有关反应的积累.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
3.下列说法中正确的是( )
| A. | 二氧化硫溶于水能导电,故二氧化硫属于电解质 | |
| B. | 硫酸钡难溶于水,故硫酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
4.下列说法正确的是( )
| A. | 常温常压下,22.4L氮气所含原子数目大于2NA | |
| B. | 1 mol Na2O2跟H2O反应转移的电子数目为2NA | |
| C. | 标准状态下,22.4L三氧化硫所含分子数目大于NA | |
| D. | 1 mol甲烷的质量与0.5 mol O2的质量不相等 |
1.某盐溶液滴入氯水无明显现象,在滴入硝酸酸化的硝酸钡,有白色沉淀生成,则某盐可能是( )
| A. | MgCl2 | B. | FeSO4 | C. | Na2SO3 | D. | ZnSO4 |
4.有一包白色固体,可能含有KI、NaBr、BaCl2中的一种或两种物质.将白色物质溶入水得无色溶液,在该溶液中加入少量稀硫酸,有白色沉淀产生;在无色溶液中加入新制取的氯水,然后再滴入淀粉溶液,溶液变为蓝色.下列推断正确的是( )
| A. | 白色固体中既有KI,又有BaCl2 | B. | 白色固体中既有NaBr,又有BaCl2 | ||
| C. | 白色固体中可能有KI | D. | 白色固体中可能没有NaBr |
8.一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD.
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd.
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
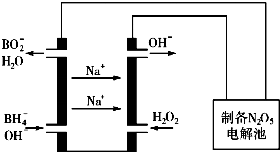
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD.
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd.
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.

9.下列实验装置或操作设计正确且能达到实验目的是( )
| A. | 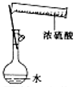 配制一定物质的量浓度的稀硫酸 | B. | 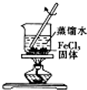 制取少量的Fe(OH)3胶体 | ||
| C. | 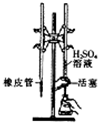 用H2SO4标准溶液滴定NaOH溶液 | D. | 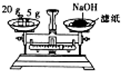 称量NaOH固体 |