题目内容
现有A、B、C、D、E、F六种常见的短周期主族元素,原子序数依次递增,A的原子半径是所有元素中最小的,B、C、D为第2周期相邻的三种元素,且原子半径B>C>D,F是第3周期元素,最外层电子数为6,C和F同主族,E和A同主族.请回答:
(1)写出元素A在元素周期表中的位置 ;
(2)C与E可形成离子化合物E2C2,试写出它的电子式 ;
(3)D与F的单质一定条件下反应生成FD6,该物质在常温下是气体,曾用于曼哈顿核计划,现广泛用于电力工业中.若FD6形成晶体,其晶体类型为 ;
(4)F的低价氧化物与C的某一种氢化物发生氧化还原反应,其化学反应方程式:
(5)在2L的密闭容器中,通入2mol FC2气体和1mol C2气体,一定温度下反应生成FC3气体,当反应达到平衡时,FC2的浓度为0.75mol?L-1,同时放出约47.5kJ的热量,该反应的热化学方程式 .
(1)写出元素A在元素周期表中的位置
(2)C与E可形成离子化合物E2C2,试写出它的电子式
(3)D与F的单质一定条件下反应生成FD6,该物质在常温下是气体,曾用于曼哈顿核计划,现广泛用于电力工业中.若FD6形成晶体,其晶体类型为
(4)F的低价氧化物与C的某一种氢化物发生氧化还原反应,其化学反应方程式:
(5)在2L的密闭容器中,通入2mol FC2气体和1mol C2气体,一定温度下反应生成FC3气体,当反应达到平衡时,FC2的浓度为0.75mol?L-1,同时放出约47.5kJ的热量,该反应的热化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A的原子半径是所有元素中最小的,则A为H元素;
F是第3周期元素,最外层电子数为6,则F为S元素;
E与A同主族,E的原子序数大于B、C、D,则E只能为Na元素;
C与F同主族,则C为O元素,B、C、D为第2周期相邻的三种元素,原子序数依次递增,则B为N元素、D为F元素,
根据以上分析可知,A为H元素、B为N元素、C为O元素、D为F元素、E为为Na元素、F为S元素,
据此完成各小题.
F是第3周期元素,最外层电子数为6,则F为S元素;
E与A同主族,E的原子序数大于B、C、D,则E只能为Na元素;
C与F同主族,则C为O元素,B、C、D为第2周期相邻的三种元素,原子序数依次递增,则B为N元素、D为F元素,
根据以上分析可知,A为H元素、B为N元素、C为O元素、D为F元素、E为为Na元素、F为S元素,
据此完成各小题.
解答:
解:A的原子半径是所有元素中最小的,则A为H元素;F是第3周期元素,最外层电子数为6,则F为S元素;E与A同主族,E的原子序数大于B、C、D,则E只能为Na元素;C与F同主族,则C为O元素,B、C、D为第2周期相邻的三种元素,原子序数依次递增,则B为N元素、D为F元素,
根据以上分析可知:A为H元素、B为N元素、C为O元素、D为F元素、E为为Na元素、F为S元素,
(1)A为H元素,位于周期表中第一周期ⅠA族,
故答案为:第一周期ⅠA族;
(2)C为O元素、E为为Na元素,C与E可形成离子化合物E2C2为过氧化钠,过氧化钠为离子化合物,其电子式为: ,
,
故答案为: ;
;
(3)D为F元素、F为S元素,D与F的单质一定条件下反应生成FD6为SF6,该物质在常温下是气体,则FD6形成的晶体为分子晶体,
故答案为:分子晶体;
(4)C为O元素、F为S元素,F的低价氧化物为二氧化硫,二氧化硫与C的某一种氢化物发生氧化还原反应,则C的氢化物为过氧化氢,二氧化硫与过氧化氢反应生成硫酸,该反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
(5)C为O元素、F为S元素,FC2气体为二氧化硫,C2气体为氧气,FC3气体为三氧化硫,该反应为二氧化硫与氧气反应生成三氧化硫,达到平衡时二氧化硫的物质的量为:0.75mol?L-1×2L=1.5mol,反应消耗的二氧化硫的物质的量为:2mol-1.5mol=0.5mol,即:消耗0.5mol二氧化硫放出约47.5kJ的热量,泽尔消耗2mol二氧化硫放出的热量为:47.5kJ×
=190kJ,则该反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol.
根据以上分析可知:A为H元素、B为N元素、C为O元素、D为F元素、E为为Na元素、F为S元素,
(1)A为H元素,位于周期表中第一周期ⅠA族,
故答案为:第一周期ⅠA族;
(2)C为O元素、E为为Na元素,C与E可形成离子化合物E2C2为过氧化钠,过氧化钠为离子化合物,其电子式为:
 ,
,故答案为:
 ;
;(3)D为F元素、F为S元素,D与F的单质一定条件下反应生成FD6为SF6,该物质在常温下是气体,则FD6形成的晶体为分子晶体,
故答案为:分子晶体;
(4)C为O元素、F为S元素,F的低价氧化物为二氧化硫,二氧化硫与C的某一种氢化物发生氧化还原反应,则C的氢化物为过氧化氢,二氧化硫与过氧化氢反应生成硫酸,该反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
(5)C为O元素、F为S元素,FC2气体为二氧化硫,C2气体为氧气,FC3气体为三氧化硫,该反应为二氧化硫与氧气反应生成三氧化硫,达到平衡时二氧化硫的物质的量为:0.75mol?L-1×2L=1.5mol,反应消耗的二氧化硫的物质的量为:2mol-1.5mol=0.5mol,即:消耗0.5mol二氧化硫放出约47.5kJ的热量,泽尔消耗2mol二氧化硫放出的热量为:47.5kJ×
| 2mol |
| 0.5mol |
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol.
点评:本题考查结构性质位置关系应用,题目难度中等,推断各元素名称是解题关键,侧重常用化学用语考查,注意理解热化学方程式的意义与书写原则.

练习册系列答案
相关题目
将如图中所示实验装置的K闭合,下列判断正确的是( )
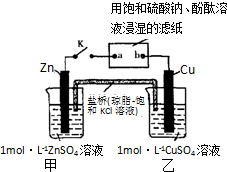

| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极上发生氧化反应 |
| C、甲池与乙池中的溶液互换,闭合K仍有电流产生 |
| D、片刻后可观察到滤纸a点变红色 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温常压下,18克H2O含有2NA个氢原子 |
| B、1mol的Cl2与足量的NaOH溶液反应转移的电子数为2NA |
| C、1mol苯分子中含有的碳碳双键数为3 NA |
| D、5mol/L的Na2CO3溶液中含有的CO32-数目小于0.5 NA |
在酸性溶液中,下列各组离子能大量共存的是( )
| A、Cl-、HCO3-、K+、SO42- |
| B、OH-、Cl-、Na+、Mg2+ |
| C、Fe3+、Na+、SO32-、I- |
| D、Na+、Cl-、I-、SO42- |
组成为
X的元素在周期表中的位置是( )
39 19 |
| A、第3周期第0族 |
| B、第4周期第ⅠA族 |
| C、第3周期第ⅠA族 |
| D、第3周期第ⅦA族 |
下列关于晶体的叙述错误的是( )
| A、分子晶体中可能不含共价键 |
| B、原子晶体中只存在共价键 |
| C、离子晶体中一定含有离子键 |
| D、分子晶体中可能含有离子键 |
由0.1mol两种气态烃组成的混合气体,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是( )
| A、混合气体中一定含有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定有乙烷 |
| D、混合气体中一定有乙炔 |