题目内容
3.实验室配制100mL 0.1mo1•L-1NaCl溶液,必须用到的玻璃仪器是( )| A. |  分液漏斗 | B. |  酒精灯 | C. |  锥形瓶 | D. |  容量瓶 |
分析 配制100mL 1mol•L-1 NaCl溶液步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,根据配制步骤选择使用的仪器.
解答 解:配制100mL 1mol•L-1 NaCl溶液过程中使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以必须使用的玻璃仪器为烧杯、玻璃棒、100mL容量瓶、胶头滴管.
故选D.
点评 本题考查了配制一定物质的量浓度的溶液中仪器选择,题目难度不大,注意掌握配制一定物质的量浓度的溶液的方法,能够根据配制步骤选择使用的仪器.

练习册系列答案
相关题目
14.如表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)请写出j原子外围电子排布式3d74s2.
(2)c、d原子半径大小c>d,第一电离能大小关系是c>d,
电负性大小关系是c<d.(以上填“>”或“<”)
(3)j元素在元素周期表中位于四周期Ⅷ族,又已知NH3•H2O的电离方程式为NH3•H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构是b (填序号,见图).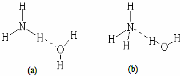
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ•mol-):
表中X、Y可能分别为以上元素中的Na、Al(填写元素符号).
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为1;该元素与元素a形成的分子X的空间构型为三角锥形.
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
(2)c、d原子半径大小c>d,第一电离能大小关系是c>d,
电负性大小关系是c<d.(以上填“>”或“<”)
(3)j元素在元素周期表中位于四周期Ⅷ族,又已知NH3•H2O的电离方程式为NH3•H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构是b (填序号,见图).

(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ•mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为1;该元素与元素a形成的分子X的空间构型为三角锥形.
18.下列化学反应热现象的描述中正确的是( )
| A. | 放热的反应不必加热就能发生 | |
| B. | 化学反应一定有能量变化 | |
| C. | 吸热反应发生过程中必须加热 | |
| D. | 化学反应热效应数值与反应物的多少无关 |
15.如表是元素周期表的一部分,回答下列问题:
请用这十二种元素回答下列问题:
(1)写出①元素的名称碳.
(2)金属性最强的元素是Na(填元素符号).
(3)元素⑩形成的两种氧化物中,能使品红溶液褪色的是SO2(填化学式).
(4)写出元素④和元素⑥形成的化合物的电子式 .
.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(1)写出①元素的名称碳.
(2)金属性最强的元素是Na(填元素符号).
(3)元素⑩形成的两种氧化物中,能使品红溶液褪色的是SO2(填化学式).
(4)写出元素④和元素⑥形成的化合物的电子式
 .
.
13.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.
下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分)
(2)B元素处于周期表中第三周期第ⅢA族.
(3)C、D的简单离子的半径由大到小顺序为S2->Cl-(填离子符号).
(4)上述五种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(5)C、E形成的化合物为SO2、SO3(填化学式).
下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)B元素处于周期表中第三周期第ⅢA族.
(3)C、D的简单离子的半径由大到小顺序为S2->Cl-(填离子符号).
(4)上述五种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(5)C、E形成的化合物为SO2、SO3(填化学式).