题目内容
12.氧化铝溶于盐酸的离子反应方程式:Al2O3+6H+=2Al3++3H2O.分析 氧化铝两性氧化物,氧化铝能够与盐酸反应生成氯化铝和水,离子方程式中氧化铝和水不能拆开,据此写出反应的离子方程式.
解答 解:Al2O3和盐酸反应生成氯化铝和水,Al2O3和水需要保留化学式,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O.
点评 本题考查了离子方程式的书写,题目难度不大,明确发生反应的原理为解答关键,注意掌握离子方程式的书写原则,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)═N2(g)+CO2(g)△H=-213.5kJ mol-1,达到平衡时的数据如下:
下列说法不正确的是( )
| 温度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{9}{16}$ | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 | |
| D. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变 |
17.向BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛两支试管,一支中加入H2O2,另一支中加入烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀生成.由此得出的下列结论合理的是( )
| A. | 氯化钡有两性 | |
| B. | 两支试管中产生的沉淀都是BaSO4 | |
| C. | 两支试管中的沉淀都是BaSO3 | |
| D. | H2SO3可被H2O2氧化为H2SO4,BaCl2与SO2不反应但能与SO${\;}_{3}^{2-}$反应 |
4.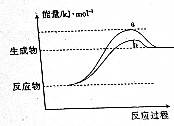 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
(1)反应历程由a变为b的原因可能是使用催化剂.
(2)不同温度下N2的转化率如图:
则a1<(填“>”、“<”或“=”)α2
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,使之反应,平衡时容器内的压强为起始时的93.75%.
①达到平衡时,N2的转化率为50%.
②598K时上述固氮反应的平衡常数K=$\frac{2}{27}$.
 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:(1)反应历程由a变为b的原因可能是使用催化剂.
(2)不同温度下N2的转化率如图:
| 温度/K | N2的转化率 |
| 598 | a1 |
| 898 | a2 |
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,使之反应,平衡时容器内的压强为起始时的93.75%.
①达到平衡时,N2的转化率为50%.
②598K时上述固氮反应的平衡常数K=$\frac{2}{27}$.
3.实验室配制100mL 0.1mo1•L-1NaCl溶液,必须用到的玻璃仪器是( )
| A. |  分液漏斗 | B. |  酒精灯 | C. |  锥形瓶 | D. |  容量瓶 |