题目内容
15.如表是元素周期表的一部分,回答下列问题:| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(1)写出①元素的名称碳.
(2)金属性最强的元素是Na(填元素符号).
(3)元素⑩形成的两种氧化物中,能使品红溶液褪色的是SO2(填化学式).
(4)写出元素④和元素⑥形成的化合物的电子式
 .
.
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar.
(1)元素①为碳元素;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强;
(3)元素⑩形成的两种氧化物中,能使品红溶液褪色的是二氧化硫;
(4)元素④和元素⑥形成的化合物为MgF2,属于离子化合物.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar.
(1)元素①为碳元素,故答案为:碳;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中Na的金属性最强,故答案为:Na;
(3)元素⑩形成的两种氧化物中,能使品红溶液褪色的是二氧化硫,化学式为SO2,故答案为:SO2;
(4)元素④和元素⑥形成的化合物为MgF2,属于离子化合物,电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表与元素周期律的应用,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
4.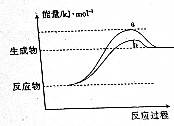 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
(1)反应历程由a变为b的原因可能是使用催化剂.
(2)不同温度下N2的转化率如图:
则a1<(填“>”、“<”或“=”)α2
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,使之反应,平衡时容器内的压强为起始时的93.75%.
①达到平衡时,N2的转化率为50%.
②598K时上述固氮反应的平衡常数K=$\frac{2}{27}$.
 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:(1)反应历程由a变为b的原因可能是使用催化剂.
(2)不同温度下N2的转化率如图:
| 温度/K | N2的转化率 |
| 598 | a1 |
| 898 | a2 |
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,使之反应,平衡时容器内的压强为起始时的93.75%.
①达到平衡时,N2的转化率为50%.
②598K时上述固氮反应的平衡常数K=$\frac{2}{27}$.
6.下列离子检验的正确的是( )
| A. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有一定有CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ | |
| C. | 加入硝酸银溶液有白色沉淀产生,则一定有Cl- | |
| D. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
3.实验室配制100mL 0.1mo1•L-1NaCl溶液,必须用到的玻璃仪器是( )
| A. |  分液漏斗 | B. |  酒精灯 | C. |  锥形瓶 | D. |  容量瓶 |
10.在一定条件下KClO3与I2按下式反应:2KClO3+I2═2KIO3+Cl2,则下列推断正确的是( )
| A. | I2发生还原反应 | |
| B. | 氧化剂为I2 | |
| C. | 还原剂为KClO3 | |
| D. | 反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
20.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R在元素周期表中的位置是第三周期VIIA族;R在自然界中有两种质量数不同的核素,它们之间的关系互为同位素.
(2)Z的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价 d.沸点XR>YX4
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm<r(Si)<0.143nm.
(5)X、M、R形成的能够杀菌、消毒物质的结构式为H-O-Cl.
(6)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价 d.沸点XR>YX4
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm<r(Si)<0.143nm.
(5)X、M、R形成的能够杀菌、消毒物质的结构式为H-O-Cl.
(6)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
5.下列化学用语表达正确的是( )
| A. | 明矾净水:Al3++3H2O?Al(OH)3↓+3H+ | |
| B. | 氯化铵溶于水:NH4++H2O?NH3•H2O+H+ | |
| C. | 亚硫酸溶液中:H2SO3?2H++SO32- | |
| D. | 在小苏打溶液中滴加氢氧化钠:HCO3-+OH-═CO2↑+H2O |