题目内容
2.微粒用${\;}_{Z}^{A}$Rn+表示,下列关于该微粒的叙述正确的是( )| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A+Z |
分析 A.${\;}_{Z}^{A}$Rn+中左下角的数字或字母表示原子的质子数;
B.中子数=质量数-质子数;
C.原子中质子数等于电子数,阳离子的电子数=质子数-电荷数;
D.${\;}_{Z}^{A}$Rn+中左上角的数字或字母表示原子的质量数.
解答 解:A.${\;}_{Z}^{A}$Rn+中的质子数为Z,故A错误;
B.左上角的数字或字母表示原子的质量数,中子数=质量数-质子数,${\;}_{Z}^{A}$Rn+中所含的中子数为A-Z,故B正确;
C.${\;}_{Z}^{A}$Rn+中的质子数为Z,电子数为Z-n,故C错误;
D.微粒${\;}_{Z}^{A}$Rn+中的质量数为A,故D错误;
故选B.
点评 本题考查离子的构成及离子中的量的关系,明确${\;}_{Z}^{A}$Rn+中质子数、质量数、中子数、电子数的关系即可解答,并注意离子中电子数的计算方法,题目难度不大.

练习册系列答案
相关题目
12.下列有关实验原理、装置、操作或结论的描述,不正确的是(有关装置的夹持仪器略去未画)( )
| A. | 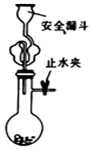 实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 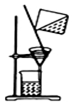 提纯氢氧化铁胶体 | D. | 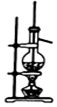 实验室用乙醇和硫酸制已烯 |
10.如图所示,下列说法正确的是( )


| A. | 甲池通入O2的电极反应为O2+4e-+4H+=2H2O | |
| B. | 乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子 | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
17.根据元素在周期表中的位置判断,下列元素中原子半径最小的是( )
| A. | 钾 | B. | 镁 | C. | 硅 | D. | 氯 |
7.下列反应正确的是( )
| A. | CH2═CH2+Br2→CH3CHBr2 | |
| B. | CH3CH═CH2+Br2→CH3CHBrCH2Br | |
| C. | CH3CH═CH2+Br2→CH3CH2CHBr2 | |
| D. | CH2═CH-CH═CH2+Br2(足量)→CH2═CH-CHBr-CH2Br |
14.下列叙述正确的是( )
| A. | 用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g) | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 对于平衡2HI(g)?I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变 | |
| D. | 由反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可得出C的非金属性强于Si |
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
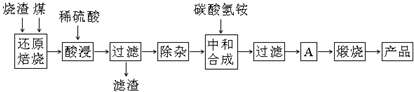
(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:4Fe2++O2+4H+=4Fe3++2H2O.
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于7.11,当pH=5时,溶液中c(Al3+)为2.0×10-6mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是CaO、MgO.
(5)A的操作是洗涤、干燥.
(6)m g烧渣经过上述工艺可得红氧化铁n g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{n×98%×56}{80m}$(用含m、n的表达式表示).

(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:4Fe2++O2+4H+=4Fe3++2H2O.
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是CaO、MgO.
(5)A的操作是洗涤、干燥.
(6)m g烧渣经过上述工艺可得红氧化铁n g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{n×98%×56}{80m}$(用含m、n的表达式表示).
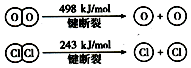 已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:


