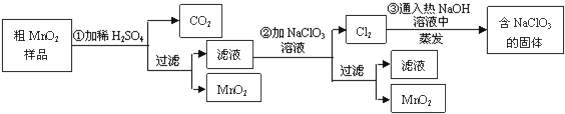
题目内容
7.下列反应正确的是( )| A. | CH2═CH2+Br2→CH3CHBr2 | |
| B. | CH3CH═CH2+Br2→CH3CHBrCH2Br | |
| C. | CH3CH═CH2+Br2→CH3CH2CHBr2 | |
| D. | CH2═CH-CH═CH2+Br2(足量)→CH2═CH-CHBr-CH2Br |
分析 A.应生成CH2BrCH2Br;
B.CH3CH═CH2与溴发生加成反应生成CH3CHBrCH2Br;
C.应生成CH3CHBrCH2Br;
D.CH2═CH-CH═CH2与足量溴反应,碳碳双键完全加成.
解答 解:A.应生成CH2BrCH2Br,方程式为CH2═CH2+Br2→CH2BrCH2Br,故A错误;
B.CH3CH═CH2与溴发生加成反应生成CH3CHBrCH2Br,故B正确;
C.应生成CH3CHBrCH2Br,方程式为CH3CH═CH2+Br2→CH3CHBrCH2Br,故C错误;
D.CH2═CH-CH═CH2与足量溴反应,碳碳双键完全加成,应生成CH2BrCHBrCHBrCH2Br,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的性质以及反应方程式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列各组离子一定能在常温指定环境中大量共存的是( )
| A. | 无色溶液中:Al3+、NH4+、Cl-、HCO3- | |
| B. | 甲基橙显红色的溶液中:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol•L-1的溶液:K+、HCO3-、I-、ClO- | |
| D. | pH值为1的溶液:Fe2+、Cl-、Na+、SCN- |
15.已知元素X,Y的核电荷数分别为a和b,它们的离子Xn+的Ym-的核外电子排布完全相同,则下列关系中正确的是( )
| A. | a+m=b-n | B. | a+b=m+n | C. | a-m=b+n | D. | a+m=b-n |
2.微粒用${\;}_{Z}^{A}$Rn+表示,下列关于该微粒的叙述正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A+Z |
12.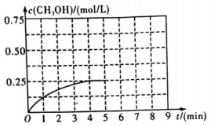 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
(1)该温度下此反应的平衡常数K为4.
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.
 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.
19.Ⅰ几种短周期元素的原子半径及主要化合价如表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
(1)R的元素符号为Al; M在元素周期表中的位置为第二周期第VIA族.
(2)X与Y按原子个数比1:1构成的物质的电子式为 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.
(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.