题目内容
14.下列叙述正确的是( )| A. | 用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g) | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 对于平衡2HI(g)?I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变 | |
| D. | 由反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可得出C的非金属性强于Si |
分析 A.反应与金属的沸点高低有关;
B.升高温度,平衡正向移动,促进水的电离;
C.缩小体积,浓度增大,颜色加深;
D.反应中C表现金属性.
解答 解:A.反应与金属的沸点高低有关,钾的沸点较低,抽走K蒸汽,降低了K蒸汽的浓度,有利于反应正向进行,钾的活泼性大于钠,用金属活动性顺序无法解释反应,故A错误;
B.水的电离为吸热反过程,升高温度,平衡正向移动,促进水的电离,水的离子积增大、pH减小,故B正确;
C.缩小体积,平衡不移动,但浓度增大,颜色加深,故C错误;
D.反应中C表现金属性,不能比较非金属性,故D错误.
故选B.
点评 本题考查较为综合,涉及化学平衡的移动,水的电离平衡以及物质的性质,为高考常见题型和高频考点,侧重考查学生的分析能力,注意把握物质的性质以及相关原理的认识,难度不大.

练习册系列答案
相关题目
5.用NA表示阿伏加德罗常致,下列说法正确的是( )
| A. | 将lmol Cl2溶于水,所得溶液中HClO、Cl-和C1O-的总数目为2NA | |
| B. | 46g NO2和N2O4混合物中含分子数为NA | |
| C. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| D. | 适量Na2O2与CO2反应生成1mol O2时,转移的电子数为2NA |
2.微粒用${\;}_{Z}^{A}$Rn+表示,下列关于该微粒的叙述正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A+Z |
9.下列图示与对应的叙述不相符的是( )
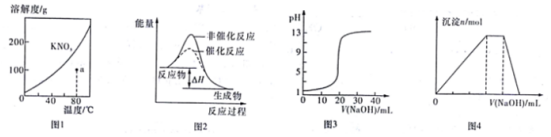

| A. | 图1表示KNO3的溶液曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别有无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. | 图4表示向NH4Al(SO4)2溶液中逐滴滴加NaOH溶液,随着NaOH溶液体积V的变化,沉淀总物质的量n的变化 |
19.Ⅰ几种短周期元素的原子半径及主要化合价如表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
(1)R的元素符号为Al; M在元素周期表中的位置为第二周期第VIA族.
(2)X与Y按原子个数比1:1构成的物质的电子式为 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.
(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
6.如图是实验室制取无水氯化镁的装置图,下列有关表述不正确的是( )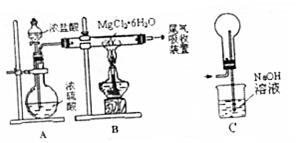

| A. | 装置A制取HCl利用了浓硫酸的吸水性 | |
| B. | 如果直接加热MgCl2•6H2O不能得到MgCl2,将得到Mg(OH)Cl或MgO | |
| C. | 用装置C做为尾气吸收装置,直接与B相连 | |
| D. | 这套装置在设计时未考虑反应结束后滞留在装置中的有害气体的吸收 |
14.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 渗析法可用于含有氯化钠的淀粉溶液的提纯 | |
| D. | 用含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
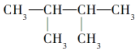 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;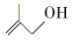 的分子式为C4H8O;
的分子式为C4H8O;