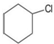
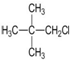
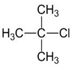
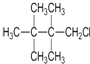
题目内容
2.我国拟大力推广使用氢氧燃料电池的公共汽车.某种以质量分数为30%的KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-,下列有关该氢氧燃料电池的说法中,正确的是( )| A. | 该电池工作一段时间后,KOH溶液的质量分数不变 | |
| B. | 供电时的总反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 该燃料电池可以用两个活性相同的电极 |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,燃料电池中电极可以是两个相同的惰性电极.
解答 解:A.电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2═2H2O,水的质量增大,KOH溶液的质量分数减小,故A错误;
B.电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2═2H2O,电池中没有发生燃烧,反应条件不是点燃,故B错误;
C.氢氧燃料电池是将化学能转变为电能的装置,氢气和氧气在两极上放电,没有发生燃烧,故C错误;
D.燃料电池中电极可以是两个相同的惰性电极,如均用碳棒作电极,故D正确.
故选D.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式以及能量的转换形式,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
10.下列有关说法正确的是( )
| A. | 赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀制成的 | |
| B. | 正常雨水的PH为7 | |
| C. | 生物质能的缺点是严重污染环境 | |
| D. | 煤、石油、沼气是当今世界最重要的三种化石燃料 |
17.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 常温常压下,8.0g CH4中含有的价电子总数为5NA | |
| C. | 在标准状况下,22.4 L CH4与NH3混合气所含有的质子总数为10NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
7.有A、B、C、D、E、F六种短周期元素,已知A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示.F的单质可与酸反应,1mol F单质与足量酸反应能产生33.6L H2(标准状况);F的阳离子与A的阴离子核外电子排布完全相同.回答下列问题:
(1)C在周期表中的位置为第三周期第ⅥA族.
(2)元素D的+1价含氧酸的电子式为 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| E | A | |||
| B | C | D |
(2)元素D的+1价含氧酸的电子式为
 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
14.下列说法正确的是( )
| A. | Fe3+具有氧化性,Fe2+具有还原性 | |
| B. | Fe3+的水溶液呈红褐色,Fe2+的水溶液呈浅绿色 | |
| C. | Fe2+的溶液中滴入强碱溶液,立即出现红褐色沉淀 | |
| D. | 铁可以在氧气中燃烧生成Fe2O3 |
12.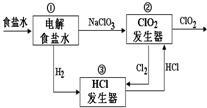 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.
装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |