题目内容
12.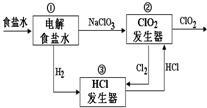 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
分析 A.电解食盐水得到氢气、氯气和氢氧化钠溶液,氢气和氯气反应生成氯化氢得到浓盐酸,制得NaClO3和浓盐酸加热反应生成ClO2;
B.装置①是电解食盐水,溶液中氢离子在阴极得到电子生成氢气;
C.装置②发生的反应是NaClO3和浓盐酸加热反应生成氯气、氯化钠和二氧化氯,阴极元素化合价变化和氧化还原反应概念分析;
D.生成的氢气和氯气反应生成氯化氢.
解答 解:A.电解食盐水得到氢气、氯气和氢氧化钠溶液,氢气和氯气反应生成氯化氢得到浓盐酸,制得NaClO3和浓盐酸加热反应生成ClO2,2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl,该流程中Cl2、NaCl都可以循环利用,故A错误;
B.装置①是电解食盐水,溶液中氢离子在阴极得到电子生成氢气,是阴极产物,故B正确;
C.电解食盐水得到氯酸钠(NaClO3)和H2,NaClO3和盐酸发生歧化反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,氯气是氧化产物,故C错误;
D.电解饱和食盐水生成的氢气,为了使H2完全转化为HCl,需要向装置③中补充Cl2,故D正确;
故选BD.
点评 本题考查海水资源的综合利用,为高频考点,把握电解原理及应用、氧化还原反应及流程分析为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.我国拟大力推广使用氢氧燃料电池的公共汽车.某种以质量分数为30%的KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-,下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | 该电池工作一段时间后,KOH溶液的质量分数不变 | |
| B. | 供电时的总反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 该燃料电池可以用两个活性相同的电极 |
3.由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )
| A. | A电极上发生的电极反应是还原反应 | |
| B. | A的金属性强于B | |
| C. | 电子不断由A电极经外电路流向B电极 | |
| D. | 溶液中的阳离子移向负极 |
17.下列有关实验的叙述对应关系不正确的是( )
| 选项 | A | B | C | D |
| 装 置 图 |  | 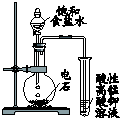 | 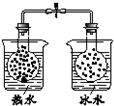 |  |
| 现 象 | 导管中液面上升 | KMnO4溶液褪色 | 热水中的NO2球红棕色加深 | 白色沉淀逐渐转化为黄色沉淀 |
| 结 论 | 该条件下,铁钉发生吸氧腐蚀 | 电石和水反应生成乙炔 | 2NO2(g)?N2O4(g)△H<0 | Ksp:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
4.下列叙述均正确且前后有因果关系的是( )
| A. | 常温,NaHCO3溶解度比Na2CO3小,向饱和Na2CO3溶液中通入CO2产生沉淀 | |
| B. | 常温,SiO2与氢氟酸、NaOH溶液均可反应,SiO2是两性氧化物 | |
| C. | BaSO3难溶于水,SO2气体通入Ba(NO3)2溶液中产生沉淀 | |
| D. | 非金属性:Cl>S,酸性:HClO>H2SO4 |
5.面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锌粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
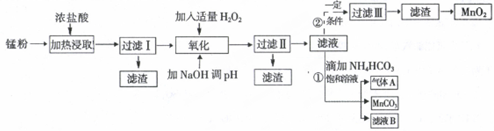
根据以上信息回答问题:
(1)过滤I得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤II后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤I得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤II后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
 CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.