题目内容
18.下列叙述中正确的是( )| A. | 含有阴离子的化合物一定含有阳离子 | |
| B. | CS2、H2O、C2H2都是直线型分子 | |
| C. | 离子化合物的熔点一定比共价化合物的高 | |
| D. | 酸性:H3PO4>H2SO4>HClO4 |
分析 A.含有阴离子的化合物,一定为离子化合物;
B.H2O中O含2对孤对电子,为V型结构;
C.共价化合物可能为原子晶体,熔点较高;
D.非金属性越强,对应最高价含氧酸的酸性越强.
解答 解:A.含有阴离子的化合物,一定为离子化合物,则一定含阳离子,故A正确;
B.H2O中O含2对孤对电子,为V型结构,而CS2、C2H2都是直线型分子,故B错误;
C.共价化合物可能为原子晶体,熔点较高,如二氧化硅的熔点高于NaCl的熔点,故C错误;
D.非金属性Cl>S>P,对应最高价含氧酸的酸性为H3PO4<H2SO4<HClO4,故D错误;
故选A.
点评 本题考查离子化合物及化学键,为高频考点,把握化合物中作用力、晶体类型与性质、酸性比较为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
5.某化学兴趣趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
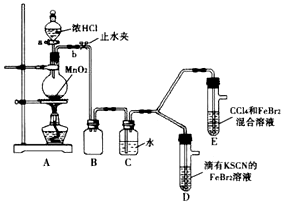
(1)①A装置中圆底烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↓+2H2O;
②检查气体发生装置 A的气密性的操作是:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
③装置B的作用是安全瓶,防止液体倒吸
(2)整套实验装置存在一处明显不足,请指出缺少尾气处理装置.
用改正后的装置进行实验.实验过程如表:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如表:
①请用平衡移动原理(结合化学用语) 解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生,请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.

(1)①A装置中圆底烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↓+2H2O;
②检查气体发生装置 A的气密性的操作是:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
③装置B的作用是安全瓶,防止液体倒吸
(2)整套实验装置存在一处明显不足,请指出缺少尾气处理装置.
用改正后的装置进行实验.实验过程如表:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适置浓盐酸,然后关闭活塞a,点燃酒精灯 | D装罝中:溶液变红,E装置中:水层溶液变黄,振荡后CCl4层无明显变化 | Cl2、Br2、Fe2+的氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如表:
| i.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2 ii.Cl2和Br2反应生成BrCl,它呈红色(略带黄色)沸点约为5℃,与水发生水解反应 iii.AgClO、AgBrO均可溶于水 |
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生,请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
6.下列叙述不正确的是( )
| A. | 1 mol H2约含有6.02×1023个氢分子 | |
| B. | 1 mol H2O的质量为18 g | |
| C. | 1 mol O2的体积为22.4 L | |
| D. | 1L 1 mol/L NaCl溶液中含1 molNa+ |
13.有四位学生分别设计了以下实验方案,并都认为如果观察到的现象和自己设计的方案一致,即可得出相应结论,你认为合理且正确的是( )
| A. | 试液$\stackrel{BaCl_{2}溶液}{→}$白色沉淀$\stackrel{足量稀盐酸}{→}$沉淀不溶解结论:试液中含SO42- | |
| B. | 试液$\stackrel{足量稀盐酸}{→}$无气体,无沉淀$\stackrel{BaCl_{2}溶液}{→}$白色沉淀结论:试液中含SO42- | |
| C. | 试液$\stackrel{足量稀盐酸}{→}$无色无味气体$\stackrel{澄清石灰水}{→}$变浑浊结论:试液中含CO32- | |
| D. | 试液$\stackrel{足量Ba(OH)_{2}}{→}$白色沉淀$\stackrel{足量稀盐酸}{→}$沉淀消失并产生无色无味气体$\stackrel{澄清石灰水}{→}$变浑浊结论:试液中含CO32- |
3.常温下,在符合各自条件的下列溶液中一定能大量共存的离子组是( )
| A. | 与Al反应产生氢气的溶液:K+、Na+、SO42-、HCO3- | |
| B. | 溶液中c(H+)/c(OH-)=1014:Fe2+、Na+、SO42-、NO3- | |
| C. | PH=12的溶液:Na+、K+、AlO2-、Cl- | |
| D. | 溶液中水所电离的H+和OH-满足c(H+)•c(OH-)=10-26:NH4+、Mg2+、SO42-、Cl- |
10.下列有关气体体积的叙述中,正确的是( )
| A. | 同温同压条件下,反应前后气体的体积之比等于气体的物质的量之比 | |
| B. | 不同的气体,若体积相同,则它们所含的分子数必相同 | |
| C. | 气体的摩尔体积是指1mol任何气体所占的体积都是22.4L | |
| D. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定 |
7.已知反应10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子总数为(NA表示阿伏加德罗常数的值)( )
| A. | 9 NA | B. | 4 NA | C. | 10 NA | D. | 5 NA |
8.关于SO2气体的叙述中,正确的是( )
| A. | SO2的摩尔质量是64 g | |
| B. | 1mol SO2中所含分子数约为6.02×1023 | |
| C. | 1 mol SO2的质量是64 g•mol-1 | |
| D. | 25℃,1.01×105Pa下,1 mol SO2的体积为22.4 L |



